Esercizi sul numero di ossidazione
Esercizi online e gratuiti sul numero di ossidazione
In questa sezione del sito vengono proposti vari esercizi sul numero di ossidazione, ovvero esercizi che richiedono il calcolo del numero di ossidazione di alcuni elementi in composti elettricamente neutri o in ioni poliatomici.
Prima di affrontare gli esercizi, ti consigliamo però di leggere questa sezione: come si assegna il numero di ossidazione.
È infatti necessario avere ben chiari tali concetti teorici.
Molti degli esercizi proposti sono svolti e commentati; ciò viene fatto con l'intento di aiutare gli studenti a capire questo fondamentale argomento della chimica generale.
Gli esercizi sono elencati in ordine crescente di difficoltà.
1.
Assegna il numero di ossidazione al calcio nello ione Ca2+.
Svolgimento
Uno ione monoatomico ha un numero di ossidazione uguale alla carica dello ione.
Pertanto il numero di ossidazione dello ione Ca2+ è +2.
2.
Assegna il numero di ossidazione all'ossigeno in O2.
Svolgimento
Gli atomi degli elementi allo stato elementare hanno numeri di ossidazione zero.
Pertanto il numero di ossidazione dell'ossigeno in O2 è zero.
3.
Assegna il numero di ossidazione ad H in CaH2.
Svolgimento
L'idrogeno ha solitamente numero di ossidazione + 1; ha invece numero di ossidazione -1 nei composti con i metalli, perché i metalli sono meno elettronegativi dell'idrogeno.
In questo caso H ha numero di ossidazione -1.
4.
Determinare il numero di ossidazione di P in H3PO4.
L'idrogeno ha numero di ossidazione +1 in quanto è legato a non metalli.
L'ossigeno ha numero di ossidazione -2.
La somma algebrica dei numeri di ossidazione di tutti gli atomi del composto deve essere uguale a zero.
Indicando con X il numero di ossidazione di P si ha quindi:
3 ·(+1) + X + 4 · (-2) = 0
da cui:
X = +5
5.
Determinare il numero di ossidazione di P in H4P2O7.
L'idrogeno ha numero di ossidazione +1 in quanto è legato a non metalli.
L'ossigeno ha numero di ossidazione -2.
La somma algebrica dei numeri di ossidazione di tutti gli atomi del composto deve essere uguale a zero.
Indicando con X il numero di ossidazione di P si ha quindi:
4 ·(+1) + 2 · X + 7 · (-2) = 0
4 + 2 · X + -14 = 0
2 · X = 14 - 4
2 · X = 10
da cui:
X = +5
6.
Determinare il numero di ossidazione di C in HCO3−.
Svolgimento
L'ossigeno ha numero di ossidazione -2
L'idrogeno ha numero di ossidazione +1.
La somma algebrica dei numeri di ossidazione di tutti gli atomi nello ione poliatomico deve essere uguale a -1.
Indicando con X il numero di ossidazione di C si ha quindi:
+1 + X + 3 · (-2) = -1
X = -1 -1 + 6
da cui:
X = +4
7.
Determinare il numero di ossidazione di Mn in MnO4−.
Svolgimento
L'ossigeno ha numero di ossidazione -2.
La somma algebrica dei numeri di ossidazione di tutti gli atomi nello ione poliatomico deve essere uguale a -1.
Indicando con X il numero di ossidazione di Mn si ha quindi:
X + 4 · (-2) = -1
da cui:
X = +7
8.
Determinare il numero di ossidazione di Cr in Cr2O72−
Svolgimento
L'ossigeno ha numero di ossidazione -2
La somma algebrica dei numeri di ossidazione di tutti gli atomi nello ione poliatomico deve essere uguale a -2.
Indicando con X il numero di ossidazione di Cr si ha quindi:
2 · X + 7 · (-2) = -2
da cui:
X = +6
9.
Determinare il numero di ossidazione di P in Ca3(PO3)2.
Svolgimento
L'ossigeno ha numero di ossidazione -2
Il Ca ha numero di ossidazione +2.
La somma algebrica dei numeri di ossidazione di tutti gli atomi del composto deve essere uguale a zero.
Bisogna inoltre tenere presente che in Ca3(PO3)2 si hanno:
- 3 atomi di Ca
- 2 atomi di P
- 6 atomo di O
Indicando con X il numero di ossidazione di P si ha quindi:
2 · 3 + 2 · X + 6 · (-2) = 0
6 + 2 · X - 12 = 0
2 · X = 6
X = +3
10.
Determinare il numero di ossidazione di Cl in Fe(ClO4)2.
Svolgimento
L'ossigeno ha numero di ossidazione -2
Il Fe ha può avere numero di ossidazione +2 e +3. In questo caso ha numero di ossidazione +2 (lo si capisce in quanto lo ione ClO4 ha carica -1).
La somma algebrica dei numeri di ossidazione di tutti gli atomi del composto deve essere uguale a zero.
Bisogna inoltre tenere presente che in Fe(ClO4)2 si hanno:
- 1 atomo di Fe
- 2 atomi di Cl
- 8 atomo di O
Indicando con X il numero di ossidazione di Cl si ha quindi:
2 + 2 · X + 8 · (-2) = 0
2 + 2 · X - 16 = 0
2 · X = 14
X = +7
11.
Attribuire il numero di ossidazione a S in S4O62−.
Svolgimento
L'ossigeno ha numero di ossidazione -2
La somma algebrica dei numeri di ossidazione di tutti gli atomi nello ione poliatomico deve essere uguale a -2.
Indicando con X il numero di ossidazione di S si ha quindi:
4 · X + 6 · (-2) = -2
4 · X = 12 - 2
Da cui:
X = + 2,5
È chiaro che un numero di ossidazione pari a +2,5 è solo formale (la mezza carica non esiste). Come è possibile osservare dalla figura seguente, ciò succede in quanto due dei quattro atomi di S hanno numero di ossidazione pari a 0 (sono legati solo ad altri atomi di zolfo), mentre gli altri due hanno numero di ossidazione +5.
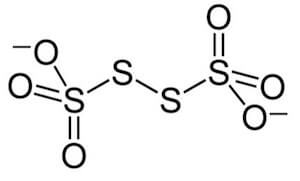
Ogni atomo di S ha mediamente numero di ossidazione +2,5.
Link correlati:
Esercizi online e gratuiti sulla nomenclatura degli ossidi
Studia con noi