Sostituzione nucleofila di primo ordine
Sostituzione nucleofila unimolecolare SN1
La sostituzione nucleofila degli alogenuri alchilici può procedere secondo due meccanismo diversi: il meccanismo SN2 e il meccanismo di sostituzione nucleofila SN1.
In questa sezione tratteremo il meccanismo SN1.
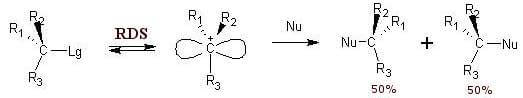
La reazione SN1 procede in due stadi: il primo stadio determina la velocità complessiva della reazione e prevede la formazione di un carbocatione intermedio:
R-X → R+ + X− (stadio lento)
Il secondo stadio della reazione (stadio veloce) prevede l'attacco nucleofilo al carbocatione:
R+ + Nu− → R-Nu (stadio veloce)
Il fatto che lo stadio proposto come stadio lento non coinvolga il nucleofilo, spiega il primo ordine cinetico e chiarisce anche perché la velocità iniziale non cambia cambiando il nucleofilo.
La formazione dell'intermedio carbocationico è lo stadio lento della reazione che condiziona e limita la velocità dell'intero processo (è il Rate Determining Step RDS).
L'equazione di velocità non contiene quindi la concentrazione del nucleofilo ed è la seguente: v = k · [R-Lg].
Un esempio di reazione che procede attraverso un meccanismo SN1 è la reazione del bromuro di t-butile con lo ione idrossido OH−:
(CH3)3C-Br + OH− → (CH3)3C-OH + Br−
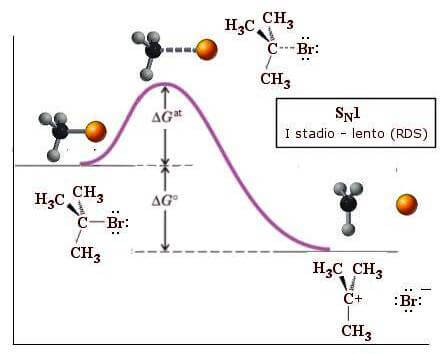
Il primo stadio della reazione (stadio lento) prevede la formazione del catione t-butilico (CH3)3C+:
Il secondo stadio della reazione (stadio veloce) prevede l'attacco nucleofilo (OH−) al catione t-butilico:
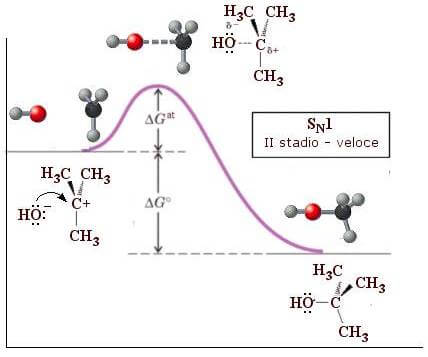
Si noti che il primo stadio della reazione, avendo una energia di attivazione (ΔGat) maggiore del secondo, costituisce lo stadio lento della reazione e determina la velocità dell'intero processo.
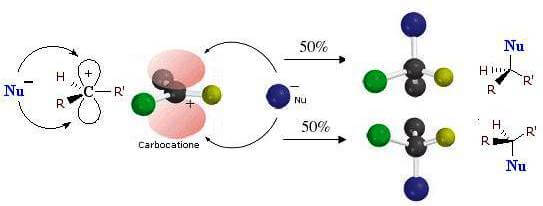
Quando si fa reagire in condizioni SN1 un alogenuro alchilico otticamente attivo si osserva una quasi completa racemizzazione del prodotto finale. Questo è dovuto al fatto che si genera come prodotto intermedio un carbocatione ibridato sp2 planare e questo può essere attaccato dal nucleofilo entrante su entrambi i lati con uguale probabilità.
Velocità relative delle reazioni SN1
Esaminiamo ora quali effetti ha la struttura del gruppo R sulle velocità relative delle reazioni di sostituzione nucleofila SN1. Poiché nella formazione dello stato di transizione viene generato un carbocatione, gli alogenuri alchilici che generano i carbocationi più stabili reagiranno più velocemente. I residui alchilici tendono a stabilizzare il cabocatione sia per effetto induttivo che iperconiugativo. In questo modo un carbocatione terziario è più stabile di un carbocatione secondario che a sua volta è più stabile di un carbocatione primario. L'ordine di reattività degli alogenuri alchilici è quindi:
terziario > secondario > primario > metilico
Trasposizione di Wagner-Meerwein
Un'ulteriore prova che il meccanismo SN1 procede attraverso un carbocatione è costituita dall'osservazione che si hanno riarrangiamenti; l'intermedio carbocationico può infatti subire un fenomeno di trasposizione, con uno shift 1,2 di un alchile o di un idrogeno a formare un carbocatione più sostituito e quindi più stabile (trasposizione di Wagner-Meerwein).
Ad esempio, lo ioduro di neopentile in acqua, in presenza di nitrato di argento, traspone a derivato 1,1-dimetilpropilico.
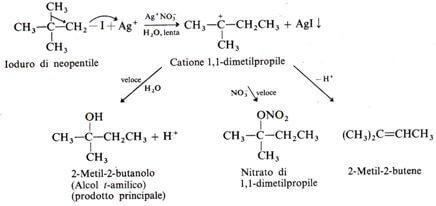
Riassumendo
Una sostituzione SN1 presenta le seguenti caratteristiche:
- la reazione avviene secondo un meccanismo a due stadi. Il primo stadio della reazione è caratterizzato dalla formazione di un intermedio carbocationico. Tale stadio è il più lento e condiziona quindi la velocità dell'intera reazione chimica.
- la cinetica della reazione è del primo ordine; la velocità di reazione può essere infatti accellerata aumentando la concentrazione del solo alogenuro alchilico. La legge cinetica di tale reazione è dunque del tipo: v = k · [R-Lg]. Lo ione idrossido non è coinvolto nello stadio determinante la velocità di reazione.
- la reazione passa attraverso la formazione un intermedio carbocationico con geometria trigonale planare.
- nel secondo stadio della reazione si ha l'attacco del nucleofilo ad uno dei due lati dell'intermedio carbocationico con formazione del legame R-Nu.
Studia con noi