Lavoro termodinamico
Che cos'è il lavoro termodinamico?
Consideriamo un sistema termodinamico costituito da un gas perfetto contenuto in un cilindro munito di pistone:
A seconda della trasformazione che il gas subisce, questo passa da una condizione iniziale ad una finale in cui possono verificarsi sostanzialmente tre situazioni:
- la variazione di volume è positiva, ΔV>0, ovvero il gas si è espanso;
- la variazione di volume è nulla, ΔV=0, ovvero il gas non ha variato il proprio volume;
- la variazione di volume è negativa, ΔV<0, il gas è stato compresso.
Ad ognuna di queste situazioni è possibile definire quanto varrà il lavoro termodinamico L subito o eseguito dal sistema.
In particolare se:
- ΔV > 0 allora il lavoro è positivo;
- ΔV = 0 allora il lavoro è nullo;
- ΔV < 0 allora il lavoro è negativo.
Rappresentazione grafica
Il piano di Clapeyron rappresenta uno strumento fondamentale per quel che riguarda il calcolo e la definizione di lavoro termodinamico.
Ricordiamo che il piano di Clapeyron riporta in ascisse il volume di un gas soggetto ad una o più trasformazioni, mentre in ordinata è riportata la pressione.
Se il gas è soggetto ad una serie di trasformazioni cicliche allora il grafico riporterà una figura chiusa:
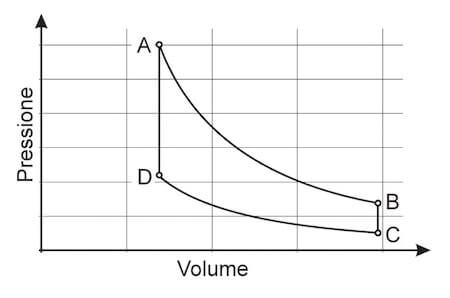
Nella figura ad esempio possiamo vedere che il gas in oggetto parte dalle condizioni di pressione, volume e temperatura identificate dallo stato A e dopo 4 trasformazioni distinte ritorna allo stato iniziale.
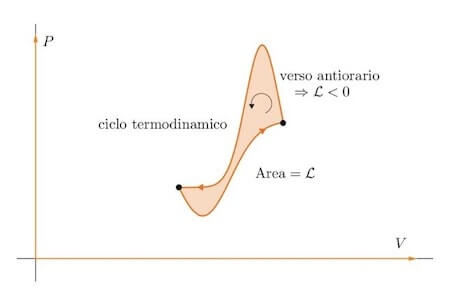
Il piano di Clapeyron è strettamente connesso al lavoro termodinamico in quanto l'area sottesa da una curva che identifica la trasformazione di un gas perfetto, rappresenta proprio il lavoro termodinamico.
Nel caso di un ciclo, l'area interna della figura che rappresenta il ciclo è proprio il lavoro del gas e tale lavoro sarà positivo se il ciclo è percorso da sinistra verso destra (verso orario), viceversa (vero antiorario) sarà negativo.
Calcolo del lavoro termodinamico per le trasformazioni dei gas perfetti
- Trasformazioni isoterme
Le trasformazioni isoterme sono quelle che avvengono a temperatura costante (T= cost) per cui la variazione di temperatura risulta nulla (ΔT=0).
In questo caso il piano di Clapeyron riporta come grafico un ramo di iperbole equilatera riferita ai propri asintoti:
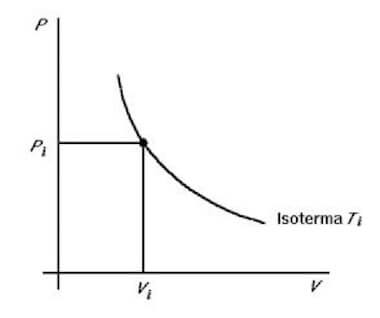
Il lavoro termodinamico sarà pari a:
L = n ∙ R ∙ T ln (V2 / V1) = n ∙ R ∙ T ln (P1 / P2)
In cui:
- n sono il numero di moli del gas;
- R è la costante dei gas perfetti che vale 8,314 J/(kg∙K);
- T è la temperatura costante espressa in Kelvin in cui avviene la trasformazione.
Ovviamente nel caso di espansione (ovvero passando da volumi inferiori a volumi superiori o allo stesso modo, considerando le pressioni, da pressioni maggiori a pressioni inferiori) il lavoro risulta positiva in quanto il rapporto V2/V1 è > 1 e pertanto il logaritmo in base naturale è positivo. Viceversa in caso di compressione sarò negativo.
- Trasformazioni isobare
Le trasformazioni isobare sono quelle che avvengono a pressione costante (P=cost) per cui la variazione di pressione risulta nulla (ΔP=0).
In questo caso il piano di Clapeyron riporta come grafico una retta orizzontale parallela all'asse dei volumi (asse x):
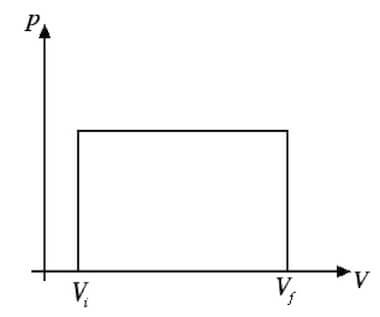
In questo caso è semplice calcolare il lavoro come area di questa retta in quanto esso sarà l'area del rettangolo che ha come base Vf-Vi = ΔV e come altezza P:
L = P∙ΔV
Ricordando l'espressione dell'equazione di stato dei gas perfetti:
P∙V = n ∙ R ∙ T
Riscrivendola come
P∙ΔV = n ∙ R ∙ ΔT
Allora il lavoro in una trasformazione isobara può essere calcolato anche come:
L = n ∙ R ∙ ΔT
Il lavoro termodinamico sarà positivo nel caso di espansione, negativo nel caso di compressione.
- Trasformazioni isocore
Le trasformazioni isocore sono quelle che avvengono a volume costante (V=cost) per cui la variazione di volume risulta nulla (ΔV=0).
In questo caso il piano di Clapeyron riporta come grafico una retta verticale parallela all'asse delle pressioni (asse y):
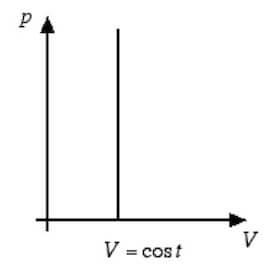
In questo caso l'area sottesa dalla curva è nulla, per cui il lavoro termodinamico per una trasformazione isocora è nullo: L = 0.
- Trasformazioni adiabatiche
Le trasformazioni adiabatiche sono quelle che avvengono senza scambi di calore (Q=cost) per cui la variazione di quantità di calore scambiata risulta nulla (ΔQ=0).
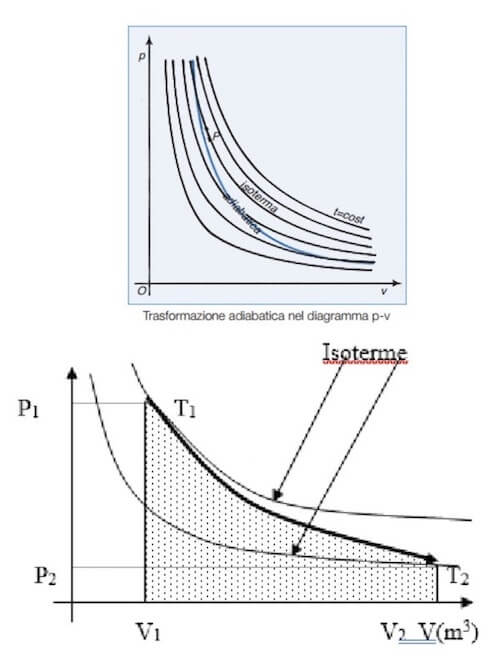
In questo caso il piano di Clapeyron riporta come grafico la curva rappresentata dall'equazione di Poisson:
P ∙ Vγ = cost
Tale curva ha come grafico un'iperbole non equilatera, ovvero un'iperbole più inclinata rispetto a quelle equilatere che rappresentano le isoterme.
In particolare poiché nella compressione adiabatica la temperatura del sistema deve aumentare, allora la curva adiabatica deve intersecare una iperbole equilatera superiore che rappresenta una temperatura superiore rispetto a quella iniziale:
Il γ che compare nella formula è il rapporto fra il calore specifico a pressione costante del gas e quello a volume costante:
γ = Cp / Cv
Questo rapporto per la maggior parte dei gas a molecola biatomica (O2 , N2 , H2, e con buona approssimazione, anche per l'aria) assume il valore medio di 7/5, mentre per i gas monoatomici vale 5/3.
Il lavoro termodinamica per una trasformazione adiabatica è pari a:
L = n ∙ Cv ∙ (T1 - T2) = (p2 ∙ V2 - p1 ∙ V1) / (1-γ)
Esercizio
Un gas perfetto compie una trasformazione che lo portano a passare dallo stato A (P = 2 ∙ 104 Pa, V = 1 m3) allo stato B caratterizzato da valori doppi di pressione e volume.
Determinare il lavoro termodinamico e specificarne il segno chiarendo se si tratta di lavoro eseguito o subito dal sistema.
Lo svolgimento dell'esercizio lo trovi qui: calcolo del lavoro termodinamico su un gas perfetto.
Studia con noi