Teoria cinetica dei gas
Generalità e proprietà della teoria cinetica dei gas
La teoria cinetica dei gas è un modello teorico che descrive un gas come un insieme di microscopiche particelle (atomi o molecole) che, nel loro continuo movimento caotico, urtano tra loro e urtano le pareti del recipiente che le contiene, come palline di gomma che rimbalzano; a causa degli urti esse cambiano continuamente direzione e velocità.
L'effetto complessivo degli urti delle singole molecole del gas contro le pareti del recipiente che lo contiene rappresenta la pressione del gas; più precisamente, la pressione di un gas in un contenitore è proporzionale al numero di urti delle particelle sull'unità di superficie e nell'unità di tempo, alla loro massa e alla loro velocità media.
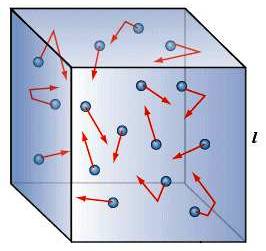
Moto caotico di un gas.
Le molecole di un gas sono permanentemente in moto, e ciascuna di esse all'istante t possiede una certa energia cinetica, di cui però non è possibile determinare il valore; ciò perché fra le molecole in moto si ha un gran numero di urti elastici e di conseguenza un continuo, caotico trasferimento di energia cinetica da una molecola all'altra (circa 1010 urti per molecola e per secondo a temperatura e pressione ambiente ).
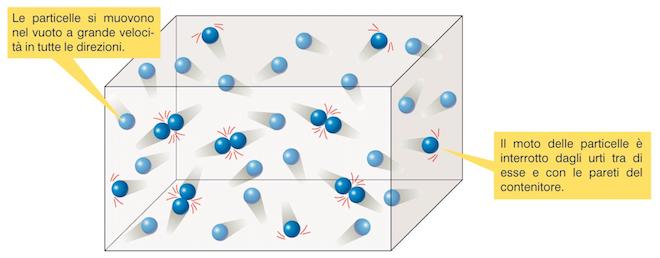
Moto caotico delle particelle di un gas: le particelle di un gas si muovono nel vuoto a grande velocità e in tutte le direzioni; il moto delle particelle è interrotto dagli urti tra di esse e con le pareti del recipiente.
Questa situazione fa sì che le molecole non abbiano, ad un dato istante e ad una data temperatura ugual valore dell'energia cinetica; pertanto quando si parla di energia cinetica delle molecole di un gas, essa va intesa sempre come energia cinetica media. A valori diversi dell'energia cinetica (Ec = ½mv2) di molecole uguali, quindi di stessa massa, corrispondono ovviamente valori diversi della loro velocità.
Cosa afferma le teoria cinetica dei gas?
Secondo la teoria cinetica, per i sistemi materiali costituiti da un numero enorme di particelle (come per i gas), non è possibile determinare per la singola particella la posizione, la velocità e l'energia, tuttavia è possibile stabilire i valori medi delle grandezze dinamiche e cinematiche messe in gioco.
In questo modo è stato possibile dimostrare che le variabili macroscopiche (pressione, volume, temperatura) messe in gioco sono strettamente correlate con grandezze microscopiche (energia cinetica, frequenza degli urti, etc.) caratteristiche delle particelle.
La teoria cinetica ha permesso infatti di stabilire la relazione esistente tra la pressione P di un gas ideale monoatomico e l'energia cinetica media Ec delle sue particelle:
![]()
dove V è il volume occupato da una mole di gas e Na è il numero di Avogadro.
Questa relazione è molto importante perché P e V sono due grandezze macroscopiche facilmente misurabili e dal loro prodotto si può ricavare l'energia cinetica media delle particelle del gas considerato.
Da questa si può risalire alla relazione esistente tra Ec delle particelle di un gas ideale e la sua temperatura assoluta T.
Infatti è sufficiente ricordare l'equazione generale dei gas perfetti che, per una mole di sostanza, diventa:
![]()
Uguagliando i due secondi membri delle due equazioni precedenti, si ha:
![]()
da cui:
![]()
Poiché R/Na è una costante (costante di Boltzmann), che si indica con la lettera k, (k = 1,3806 · 10-23 J/K) diviene:
![]()
Ciò permette di stabilire che: l'energia cinetica medie delle particelle di un gas ideale monoatomico dipende solo dalla temperatura assoluta (non dalla pressione o dal tipo di atomo) ed è a essa proporzionale.
Pertanto la temperatura di un corpo è una misura dell'energia cinetica media delle particelle che compongono il gas.
Poiché l'unico moto possibile per una particella puntiforme è quello di traslazione, Ec, assume in significato di energia cinetica traslazionale media.
Se le particelle del gas sono pluriatomiche, per esempio biatomiche (H2, O2, N2, ecc.) si comportano come un sistema rigido che può ruotare intorno al comune centro di massa (o baricentro): al moto di traslazione si sovrappone quindi il moto di rotazione.
L'energia cinetica media sarà data in questo caso dalla somma di Ec di traslazione e di Ec di rotazione.
Link correlati:
Formulario di fisica in formato pdf
Che cosa affermava la teoria del fluido calorico?
Studia con noi