Tensione superficiale
Che cos'è la tensione superficiale?
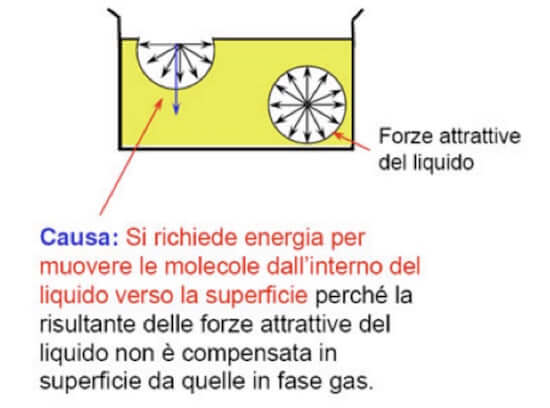
Consideriamo un liquido (ad esempio acqua) contenuta all'interno di un recipiente.
Ciascuna molecola interna alla massa del liquido, è circondata da ogni parte da altre molecole che tendono ad attrarla.
La molecola è ugualmente sollecitata in tutte le direzioni e la risultante delle sollecitazioni è nulla (si veda immagine seguente).
Nello strato superficiale invece si hanno molecole le cui sollecitazioni non sono ugualmente distribuite in tutte le direzioni.
Ciò succede in quanto nella fase gassosa sovrastante il numero di molecole presenti nell'unità di volume è assai minore che nella fase liquida.
Di conseguenza la sommatoria di tutte le sollecitazioni che agiscono su ciascuna molecola presente in superficie non è nulla ma è diretta verso l'interno del liquido.
La superficie di un liquido tende perciò a contrarsi ed infatti ogni quantità di liquido tende a ridurre al minimo la sua superficie (non a caso una goccia di acqua ha una forma sferica: la sfera è la figura geometrica che a parità di volume ha superficie minore).
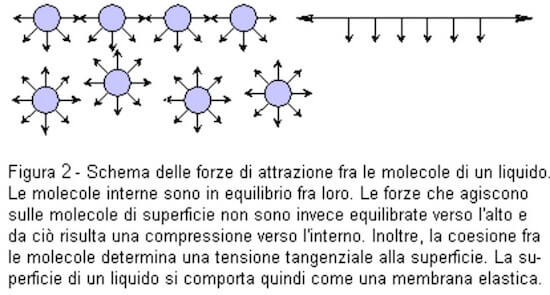
In altre parole, le forze che agiscono sulle molecole di superficie non sono equilibrate verso l'alto e da ciò risulta una compressione verso l'interno.
Inoltre, la coesione tra le molecole determina una tensione tangenziale alla superficie.
La superficie di un liquido si comporta come una membrana elastica.
La forza superficiale di coesione tra le molecole appena descritta prende il nome di tensione superficiale.
Definizione di tensione superficiale da un punto di vista quantitativo
Immaginiamo di effettuare idealmente un taglio della lunghezza di 1 centimetro nello strato superficiale di un liquido: viene indicata come tensione superficiale del liquido la forza, tangente alla superficie e perpendicolare al taglio, che tiene unite le due labbra di questo.
La tensione superficiale viene espressa in N/m e indicata con la lettera greca γ (gamma); nel sistema CGS è invece espressa in dyn/cm (si legga: dyne su centimentro).
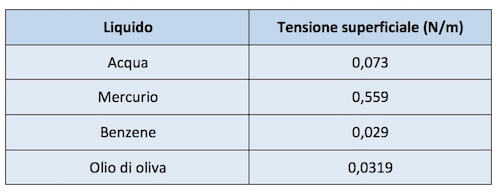
Nella tabella seguente sono riportati i valori della tensione superficiale di alcuni liquidi a contatto con l'aria calcolati alla temperatura di 20°C.
All'aumentare della temperatura diminuisce il valore della tensione superficiale, che perde significato alla temperatura critica a cui non esiste più la superficie di separazione tra liquido e vapore.
La tensione superficiale è responsabile del fenomeno della capillarità.
Se la superficie di un liquido invece di essere a contatto con una fase gassosa è a contatto con un altro liquido con il quale è immiscibile (esempio acqua/mercurio), allora si parla di tensione interfacciale.
Studia con noi