Punto critico dell'acqua
Che cos'è il punto critico dell'acqua?
Se si riscalda una opportuna quantità di acqua liquida contenuta in un capillare saldato di quarzo ed a pareti assai spesse (tubo di Natterer), giunti alla temperatura di 374,1°C (temperatura critica dell'acqua) scompare la separazione fra liquido e vapore e all'interno del capillare si ha un'unica fase detta fase critica.
La pressione della fase critica (218,3 atm nel caso dell'H2O) prende il nome di pressione critica (la pressione critica può anche considerarsi come il valore limite dalla pressione di vapor saturo di un liquido, e quindi nel nostro caso dell'acqua), mentre la temperatura della fase critica prende il nome di temperatura critica (per l'acqua vale 374,1°C).
Il punto critico dell'acqua è pertanto quella particolare coppia di valori di temperatura e di pressione al di sopra della quale l'acqua non può più esistere come miscela bifase vapore-liquido ma esiste come fluido supercritico. La pressione corrispondente alla fase critica dell'acqua si chiama pressione critica dell'acqua (e vale come detto 218,3 atm), mentre la temperatura corrispondente alla fase critica prende il nome di temperatura critica (che per l'acqua vale 374,1°C).
Dal diagramma di stato dell'acqua è facile individuare il punto critico dell'acqua; si noti infatti che il tratto della curva OB non si estende indefinitamente ma si interrompe alla temperatura di 374,1°C e alla pressione di 218,3 atm (che sono rispettivamente la temperatura critica e la pressione critica dell'acqua, coppia di valori che determina il punto critico dell'acqua).
Ciò esprime ed evidenzia il fatto che al di sopra di tale temperatura e di tale pressione la fase liquida e la fase vapore dell'acqua diventano indistinguibili.
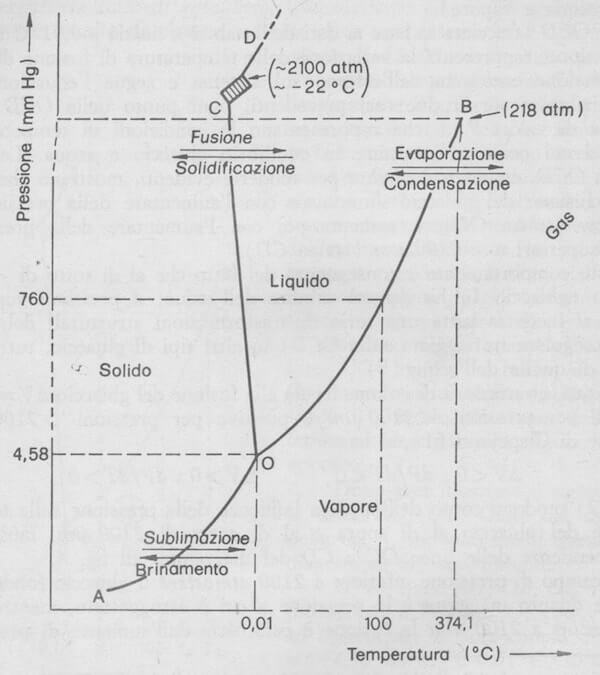
Diagramma di stato dell'acqua: il punto B del grafico corrisponde al punto critico dell'acqua: esso cade alla temperatura di 347,1°C e alla pressione di 218,3 atm.
Temperatura critica dell'acqua (374,1°C), pressione critica dell'acqua (218,3 atm) e densità critica dell'acqua (cioè densità della fase critica = 0,400 g/cm3) determinano il punto critico dell'acqua; tali dati prendono il nome di dati critici dell'acqua.
Temperatura critica, pressione critica e densità critica dell'acqua
Nella tabella seguente riportiamo i valori della temperatura critica (in °C e in K), della pressione critica (in atm e in MPa) e della densità critica (in g/cm3) dell'acqua*:
Temperatura critica dell'acqua in gradi centigradi = 374,1 °C
Temperatura critica dell'acqua in kelvin = 647,3 K
Pressione critica dell'acqua in atmosfere = 218,3 atm
Pressione critica dell'acqua in megapascal (= 106 Pa) = 22,119 MPa
Densità critica dell'acqua in grammi su centimetro cubo = 0,400 g/cm3
* Nella conversione da temperatura in gradi centigradi a temperatura in kelvin si ricordi che la temperatura in °C deve essere sommata al valore fisso di 273,16. Nella conversione tra atmosfere e Pascal si ricordi che 1 atm = 101325 Pa.
Temperatura critica e differenza tra gas e vapore
Dal punto di vista strettamente microscopico, tra gas e vapore non esiste alcuna differenza: le molecole di ossigeno e del vapore acqueo si comportano nello stesso identico modo, però il primo è considerato un gas, mentre il secondo è un vapore.
Ma perché il vapore acqueo è considerato un vapore e non un gas?
Un aeriforme che si trova ad una temperatura superiore a quella critica è detto gas, mentre un aeriforme che si trova ad una temperatura inferiore a quella critica è detto vapore. Ciò equivale a dire: il gas non è liquefacibile per compressione; il vapore è liquefacibile per compressione.
Una stessa specie chimica può comportarsi quindi da gas o da vapore a seconda che si trovi ad una temperatura superiore o inferiore alla sua temperatura critica.
Considerato che l'acqua ha una temperatura critica di 374,1°C, il suo stato aeriforme è considerato un vapore in quanto la sua temperatura critica è nettamente al disopra della temperatura ambiente media; allo stesso modo l'ammoniaca è un vapore in quanto la sua temperatura critica tcr = 132,5 °C è nettamente superiore alla temperatura ambiente media.
Link correlati:
Che cos'è un diagramma di stato?
Studia con noi