Precipitazione frazionata di idrossidi
Separazione di due cationi metallici tramite precipitazione selettiva dei loro idrossidi
Molti cationi, reagendo con gli ioni OH−, possono precipitare come idrossidi poco solubili.
Per un generico catione metallico bivalente (M2+), la reazione di precipitazione può essere rappresentata come qui di seguito:
![]()
La reazione di precipitazione ha luogo nel caso in cui il prodotto ionico dell'idrossido sia superiore al valore di Kps.
La precipitazione frazionata di idrossidi è una tecnica largamente utilizzata in chimica analitica per separare due (o più) cationi metallici da una soluzione mediante l'aggiunta di un reattivo (per esempio una soluzione diluita di NaOH, che fornisce gli ioni OH−) che precipita prima un idrossido e poi l'altro.
La separazione dei due cationi metallici è quindi possibile regolando il pH della soluzione.
Supponiamo di avere due cationi metallici Me1n+ e Me2n+ alla stessa concentrazione iniziale.
Indicando con pHi e pHf il pH di inizio e di fine precipitazione, nel caso in cui è possibile precipitare selettivamente i due idrossidi, si ha un grafico del tipo:
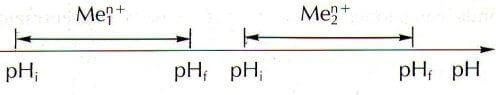
In questi casi, regolando il pH è quindi possibile effettuare una precipitazione frazionata.
Se invece non è possibile precipitare selettivamente i due idrossidi in quanto i due idrossidi precipitano contemporaneamente, si ha un grafico del tipo:
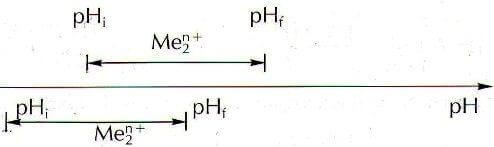
Come prevedere se è possibile effettuare una precipitazione selettiva di due idrossidi
Verifichiamo se è possibile separare quantitativamente Cu2+ e Mn2+ come idrossidi da una soluzione in cui i due cationi sono presenti in concentrazione 0,1 mol/L. KpsCu(OH)2 = 1,5 · 10-19 ; KpsMn(OH)2 = 4,0 · 10-14.
Poiché gli idrossidi presentano gli stessi rapporti stechiometrici (1:2) e la stessa concentrazione iniziale, il primo a precipitare sarà l'idrossido con il valore di Kps più piccolo e quindi Cu(OH)2.
Determiniamo la concentrazione limite [OH−] superata la quale lo ione Cu2+ inizia a precipitare come idrossido.
Sappiamo che:
![]()
Siccome [Cu2+] = 0,1M, si ha che:
2.gif)
da cui pH = 5,1, che rappresenta il pH di inizio precipitazione dello ione Cu2+ come idrossido Cu(OH)2.
Per determinare il pH di fine precipitazione di Cu(OH)2, bisogna stabilire a quale concentrazione residua il catione metallico può ritenersi completamente precipitato. Si ritiene che uno ione sia precipitato completamente quando la sua concentrazione residua in soluzione è 10-6 mol/L. Pertanto:
2.gif)
da cui pH = 7,6, che rappresenta il pH di fine precipitazione dello ione metallico Cu2+ come idrossido Cu(OH)2.
Ripetendo lo stesso procedimento, si ha che il pH di inizio precipitazione dello ione Mn2+ come idrossido Mn(OH)2 è 7,8, mentre il pH al quale la precipitazione può ritenersi conclusa è 10,3.
Riportando i dati ottenuti su una scala di valori crescenti di pH si ha che:
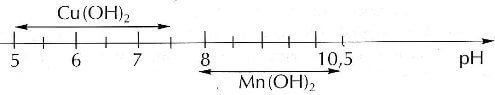
dalla quale è possibile capire che la precipitazione selettiva di Cu2+ e Mn2+ è possibile in quanto a pH=7,6, pH al quale lo ione Cu2+ è stato completamente precipitato, lo ione Mn2+ non ha ancora incominciato a precipitare.
Studia con noi