Precedenza di scarica
Elettrolisi di una soluzione contenente più ioni
Supponiamo di dover fare l'elettrolisi di una soluzione in cui più specie chimiche competono per lo stesso elettrodo nella reazione di ossidazione o di riduzione.
Il problema è capire quale specie chimica presente in soluzione ha la precedenza di scarica.
Ad esempio: se facciamo l'elettrolisi di una soluzione acquosa di NaCl, competeranno per la reazione di ossidazione all'anodo sia gli ioni OH− provenienti dall'acqua sia gli ioni Cl− provenienti dal cloruro di sodio; al catodo competeranno per la reazione di riduzione gli ioni H+ provenienti dall'acqua e gli ioni Na+ provenienti dal sale.
Il problema è capire quali ioni, che competono per lo stesso elettrodo, hanno la precedenza di scarica.
Sperimentalmente è possibile dimostrare che, a parità di concentrazione, al catodo riducono le specie che hanno un maggior potenziale di riduzione standard, mentre all'anodo si ossidano quelle specie chimiche che hanno un minor potenziale di riduzione standard.
La precedenza di scarica, come era logico aspettarsi, dipende dalla maggiore o dalla minore tendenza ad acquistare o perdere elettroni che viene misurata dal valore del potenziale standard di riduzione.
Riassumendo:
- al catodo si riduce prima la specie che presenta il potenzial standard di riduzione più elevato;
- all'anodo si ossida prima la specie chimica che presenta il potenziale standard di riduzione più basso.
Precedenza di scarica: esercizio
Prevedere quale specie si ossida e quale si riduce in una soluzione acquosa 1M di KI.
Precedenza di scarica all'anodo
All'anodo sono tre le specie (OH−, I−, H2O) che competono nella reazione di ossidazione.
Le reazioni di riduzione comprensive dei relativi potenziali standard sono i seguenti:
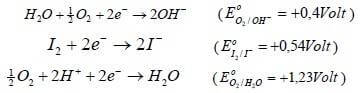
Se tutte e tre le specie avessero concentrazione 1M, in base a quanto detto in precedenza, la specie che si ossiderebbe sarebbe quella con potenziale di riduzione più basso e quindi lo ione OH−.
In realtà, in una soluzione neutra e quindi a pH = 7 (pH neutro), la concentrazione degli ioni OH− e degli ioni H+ non è 1M ma bensì 10-7M (la pressione parziale di O2 è invece 0,2 atm).
Per determinare quale specie ha la precedenza di scarica bisogna determinare quindi il potenziale di riduzione tramite l'equazione di Nernst. Si ha:
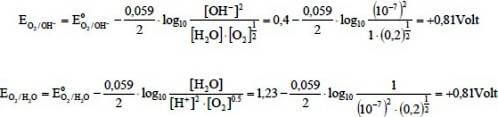
Come è possibile notare il potenziale di riduzione più basso è proprio quello dello ione ioduro (0,54 V) che si scarica all'anodo liberando I2.
Precedenza di scarica al catodo
Anche al catodo sono tre le specie (H+, K+, H2O) che competono nella reazione di riduzione:
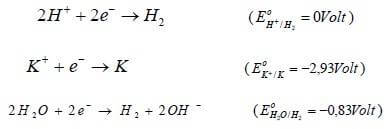
Se tutte e tre le specie avessero concentrazione 1M, in base a quanto detto in precedenza, la specie che si ridurrebbe sarebbe quella con potenziale di riduzione più alto e quindi lo ione H+.
In realtà, in una soluzione neutra e quindi a pH = 7, la concentrazione degli ioni OH− e degli ioni H+ non è 1M ma bensì 10-7M (la pressione parziale di O2 è invece 0,2 atm).
Per determinare quale specie ha la precedenza di scarica bisogna quindi calcolare il potenziale di riduzione tramite l'equazione di Nernst.
Si ha:
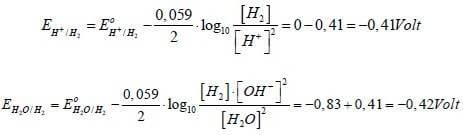
Come è possibile notare il potenziale di riduzione più alto rimane quello dello ione H+ (0 V) che si scarica al catodo liberando H2.
Esercizi sulle pile
Li trovi al seguente link: esercizi sulle pile.
Studia con noi