Legge di Graham
Enunciato e spiegazione della legge di Graham
Consideriamo due gas diversi che escono da un foro di piccole dimensioni:
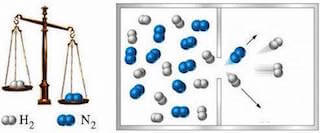
Fuoriuscita di due gas da un capillare.
La legge di Graham (1829) afferma che la velocità con cui un gas fuoriesce da un foro di piccole dimensioni è inversamente proporzionale alla radice quadrata della sua massa molecolare (MM):
![]()
Essendo la velocità di effusione inversamente proporzionale al tempo che impiega un gas a fuoriuscire da un foro di piccole dimensioni, la legge di Graham può anche essere enunciata nel seguente modo: il tempo che impiega un gas a fuoriuscire da un foro di piccole dimensioni è direttamente proporzionale alla radice quadrata della sua massa molecolare.
![]()
Nel seguente grafico sono stati riportati i tempi di effusione di gas diversi nelle medesime condizioni sperimentali: si noti che, come è stato appena detto, il tempo di effusione di un gas è direttamente proporzionale alla radice quadrata della sua massa molecolare.
Il grafico che si ottiene diagrammando la radice quadrata della massa molecolare di gas diversi in funzione dei rispettivi tempi di effusione è infatti una retta passante per l'origine.
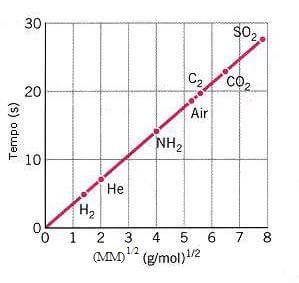
Rappresentazione grafica della legge di Graham.
Nelle identiche condizioni sperimentali, misurando il tempo di effusione di due gas, è possibile, conoscendo la massa molecolare di uno dei due, determinare la massa molecolare incognita dell'altro:
![]()
Essendo il tempo che impiega un gas a fuoriuscire da un foro di piccole dimensioni inversamente proporzionale alla velocità di effusione, possiamo anche scrivere:
![]()
In passato tale tecnica è stata utilizzata per determinare la massa molecolare di gas.
Sottolineamo il fatto che la legge di Graham è tanto valida per l'effusione quanto per la diffusione.
Si tenga infine presente che:
1) malgrado il fatto che le velocità istantanee delle singole particelle di un gas siano molto elevate (centinaia di metri al secondo a condizioni ambiente), la velocità media con cui le molecole di un gas si spostano nella massa gassosa in una direzione, dando luogo nel loro insieme alla diffusione del gas, è assai bassa (qualche centimetro al secondo a condizioni ambiente); ciò per l'elevato numero di urti che, a causa della agitazione termica, hanno costantemente luogo fra le molecole (circa 1010 urti per secondo e per molecola a condizioni ambiente).
2) affinché la velocità di effusione dei gas risulti il più possibile proporzionale alla velocità delle molecole e non intervengano quindi moti vorticosi e convettivi durante la effusione, il gas viene fatto effondere attraverso fori piccolissimi, dell'ordine di 10-4 cm di raggio (per abbreviare la durata dell'esperienza si usano setti di opportuna porosità, che presentano un gran numero di fori).
Formula della legge di Graham
Vediamo ora come è possibile ricavare teoricamente la formula della legge di Graham.
Sappiamo dalla teoria cinetica dei gas che alla stessa temperatura le molecole di tutti i gas hanno uguale energia cinetica media, cioè che:
![]()
in cui v1 e v2 sono le velocità medie dei due gas. Pertanto si può scrivere:
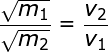
Quest'ultima equazione mostra che, alla stessa temperatura, due particelle di massa m1 ed m2 si muovono e quindi diffondono con velocità inversamente proporzionali alle radici quadrate delle loro masse. Tale equazione può essere scritta in altra forma, più comoda per i nostri scopi; infatti tenendo presente che:
1) a parità di condizioni sperimentali, le velocità con cui volumi uguali di gas diversi effondono attraverso un foro di piccole dimensioni sono inversamente proporzionali ai tempi (t) impiegati a effondere;
b) che il rapporto (m1/m2) fra le masse delle particelle è uguale al rapporto fra i rispettivi pesi molecolari (MM1/MM2); l'equazione precedente può scriversi:
![]()
Quest'ultima equazione, come già detto, consente di calcolare il peso molecolare di un gas mediante la misura dei tempi di effusione (nelle stesse condizioni sperimentali) di volumi uguali del gas in esame e di un altro gas di MM nota.
Esercizio
Attraverso un certo setto poroso, e nelle stesse condizioni sperimentali, 1 cc di O2 (MM = 32 uma) diffonde in 10,00 minuti e 1 cc di un gas non noto diffonde in 12,00 minuti.
Si determini il peso molecolare (MM) del gas incognito.
Svolgimento dell'esercizio
L'esercizio propone il calcolo del peso molecolare di un gas incognito sapendo che, nelle stesse condizioni sperimentali, 1 cc di O2 diffonde attraverso un setto poroso in un tempo di 10,00 minuti e 1 cc di un gas non noto diffonde in un tempo di 12,00 minuti.
In base alla legge di Graham, si ha che:
![]()
in cui t1 e t2 sono i tempi di diffusione dei due gas mentre MM1 ed MM2 sono i pesi molecolari dei due gas. Nel nostro caso particolare:
t1 = 10,00 minuti
MM1 = 32 uma
t2 = 12,00 minuti
MM2 = ?
Da cui:
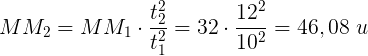
Pertanto il peso molecolare del gas incognito è 46,08 uma.
Esercizio
Sapendo che MM (H2) = 2 uma e sapendo che l'ossigeno (O2) ha un tempo di diffusione 4 volte maggiore dell'idrogeno, determinare la massa molecolare dell'ossigeno.
Lo svolgimento dell'esercizio lo trovi qui: esercizio sulla legge di Graham.
Esercizi sui gas
Li trovi online e svolti al seguente link: esercizi sui gas.
Link correlati:
Esercizio sul calcolo dell'energia cinetica media delle particelle di un gas
Studia con noi