Diluizione alcool
Come si effettua la diluizione dell'alcool?
Molto spesso è necessario procedere alla diluizione dell'alcool con lo scopo di preparare specifici liquori, come ad esempio il limoncello, soluzioni alcoliche disinfettanti o ancora specifiche soluzioni idroalcoliche.
Diluire una soluzione significa aggiungere in essa del solvente (nel nostro caso acqua) in modo tale che la sua concentrazione diminuisca; la diluizione è infatti una operazione che comporta l'aggiunta di acqua ad una soluzione in modo da portare il valore della sua concentrazione da un valore iniziale Ci ad un valore finale Cf (in cui Ci è maggiore di Cf).
Attenzione!
È bene tenere presente che nella preparazione di soluzioni alcoliche da utilizzare in campo alimentare è importante l'impiego di alcool puro a 96°; è assolutamente vietato l'uso di alcool denaturato (quello rosa per intenderci) che contiene sostanze che lo rendono non commestibile (per maggiori info: alcol denaturato).
Bisogna anche tenere presente che l'alcol etilico è una sostanza altamente infiammabile; la sua manipolazione deve essere pertanto eseguita lontano da fonti di calore, fiamme, scintille, ecc. che potrebbero innescare la combustione dell'alcool. È anche assolutamente vietato fumare durante la manipolazione dell'alcool.
In questa lezione vedremo come si effettua la diluizione dell'alcool; tramite valori numerici che potrete estrapolare da una tabella, vedremo inoltre come bisogna procedere per effettuare tali diluizioni.
Premessa: la seguente pagina non vuole essere un esercizio di chimica ma una guida pratica rivolta a tutti gli utenti che hanno la necessità di diluire l'alcol etilico con lo scopo di preparare bevande alcoliche o soluzioni alcoliche disinfettanti.
Nei calcoli che seguono considereremo i volumi di acqua e di alcol etilico additivi: se questo è sicuramente sbagliato da un punto di vista analitico è assolutamente irrilevante per lo scopo che ci siamo prefissati.
Tabella diluizione alcool
Nella tabella di seguito proposta sono indicati i mL di acqua (ricordiamo che 1 mL di acqua corrisponde a 1 g) che sono necessari per diluire 100 mL di alcool etilico di nota gradazione alcolica a una gradazione alcolica inferiore.
Bisogna anzitutto conoscere la gradazione alcoolica dell'alcol concentrato che andremo a diluire e stabilire la gradazione alcolica a cui vogliamo diluire l'alcool.
Individuiamo il valore della gradazione alcolica dell'alcol concentrato tra i valori riportati nella seconda riga (quella in giallo) e successivamente individuare il valore della gradazione alcolica finale tra i valori della prima colonna (quella in azzurro).
Incrociando i due valori è possibile determinare la quantità in grammi di acqua (ricorda: 1 g di acqua = 1 mL di acqua) da aggiungere a 100 mL di alcool concentrato per ottenere la diluizione voluta.
Esempio: per diluire un alcool a 90° e ottenere un alcool a 60°, si devono aggiungere 50,0 g di acqua (= 50,0 mL) a 100 mL di alcool etilico puro al 90%.
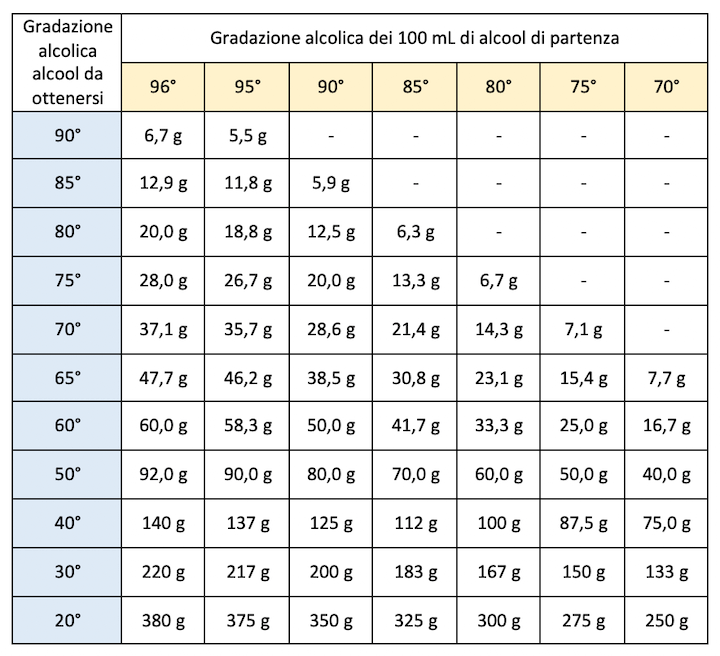
Tabella diluizione alcool.
Partendo invece da 10 mL di alcool concentrato per poi diluirlo ad una determinata concentrazione alcolica, la quantità di acqua da aggiungere sarà esattamente la decima parte della quantità riportata in tabella.
Così, ad esempio, se vogliamo diluire 10 mL di alcool a 95° e ottenere una soluzione idroalcolica a 50°, si devono aggiungere 9,0 g (= 9,0 mL) di acqua a 10 mL di alcool etilico puro al 95%.
Link correlati:
Come si effettua la diluizione dell'alcool a 90 gradi?
Come si effettua la diluizione alcool da 90° a 70°?
Come si effettua la diluizione alcool da 96° a 70°?
Esercizio svolto sulla diluizione 1 a 50
Come si effettua una diluizione 1 a 10?
Preparazione di soluzioni standard diluite da una soluzione standard concentrata
Studia con noi