Costante di equilibrio e temperatura
Come varia il valore della costante di equilibrio con la temperatura
Per una data reazione, la costante di equilibrio Keq ha un valore caratteristico a ogni data temperatura, il che significa che al variare della temperatura anche la Keq varia.
Per reazioni endotermiche (ΔH > 0) un aumento di temperatura provoca lo spostamento dell'equilibrio verso destra in quanto il calore fornito viene assorbito dai reagenti per formare i composti più energetici (prodotti).
![]()
Come conseguenza si avrà un aumento del valore della Keq.
Per reazioni esotermiche (ΔH < 0)
![]()
un aumento di temperatura provoca lo spostamento dell'equilibrio verso sinistra. Come conseguenza si avrà una diminuzione del valore della Keq.
Una diminuzione della temperatura sposta invece i due equilibri in senso opposto rispetto a quello che si ha fornendo calore.
Questi concetti sono riassunti nel seguente grafico in cui è rappresentato l'andamento della Keq al variare della temperatura sia per una reazione esotermica che per una reazione endotermica:
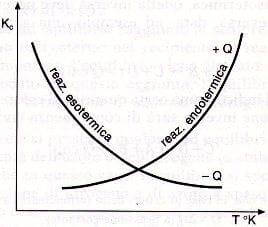
Costante di equilibrio in funzione della temperatura
Considerando per esempio la seguente reazione esotermica:
![]()
la cui costante di equilibrio è data dalla relazione:
![]()
Per prevedere in modo semplice lo spostamento dell'equilibrio in seguito ad una variazione di temperatura, si può considerare il calore di reazione come se fosse un reagente o un prodotto della reazione.
Pertanto, in base al principio di Le Chatelier, una diminuzione della temperatura (raffreddamento) favorisce la reazione diretta esotermica aumentando il valore della Keq, mentre un aumento della temperatura (riscaldamento) favorisce la reazione inversa endotermica con una diminuzione del valore della Keq.
Esercizi sugli equilibri
Li trovi svolti ed online al seguente link: esercizi sugli equilibri.
Studia con noi