Acido clorico
Proprietà e caratteristiche dell'acido clorico
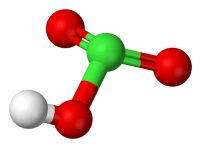
L'acido clorico è un acido ternario con formula chimica HClO3.
Nell'acido il cloro ha numero di ossidazione +5.
Si ottiene formalmente per reazione dell'anidride clorica con acqua:
Cl2O5 + H2O → 2 HClO3
Sintesi dell'acido clorico
Fu J. L. Gay-Lussac ad ottenerlo per primo in soluzione acquosa per reazione del clorato di bario con acido solforico:
Ba(ClO3)2 + H2SO4 → BaSO4 + 2 HClO3
Un altro metodo per ottenere l'acido clorico consiste nel riscaldare l'acido ipocloroso HClO. Come prodotti della decomposizione si ottengono l'acido cloridrico HCl e l'acido clorico HClO3:
3 HClO → HClO3 + 2 HCl
Caratteristiche dell'acido clorico
L'acido clorico è un acido relativamente stabile; la soluzione diluita è incolore e priva di odore.
Si può concentrare nel vuoto fino alla densità 1,282 g/cm3 corrispondente ad un contenuto del 40,1% di acido clorico.
Per ulteriore evaporazione si decompone con formazione di cloro ed ossigeno :
4 HClO3 → 2 Cl2 + 5 O2 + 2 H2O
Contemporaneamente l'acido si disproporziona secondo la reazione:
3 HClO3 → 2 ClO2 + HClO4 + H2O
L'acido clorico concentrato ha un odore pungente ed è un forte ossidante.
Ferro, stagno, bismuto e rame si sciolgono senza sviluppo di idrogeno.
Magnesio, zinco, alluminio svolgono invece idrogeno.
Mg + HClO3 → Mg(ClO3)2 + H2
Struttura dell'acido clorico
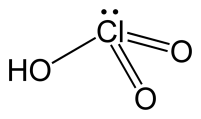
Struttura 3D
Usi dell'acido clorico
Dei sali dell'acido clorico i soli importanti tecnicamente sono i sali di sodio e di potassio.
Studia con noi