EDTA
EDTA o acido etilendiammonotetracetico
L'EDTA o acido etilendiammonotetracetico è un composto organico con formula bruta C10H16N2O8.
Presenta la seguente struttura:
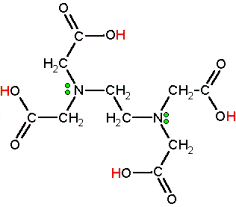
L'EDTA è uno dei derivati della etilendiammina che col nome di Trilon B ha dapprima acquistato importanza come mezzo di "addolcimento" delle acque dure e più recentemente come "sequestrante" di cationi metallici in chimica analitica.
Preparazione dell'EDTA
Per l'EDTA non si può parlare di vera preparazione industriale, dato il consumo limitato del composto.
L'EDTA viene ottenuto facendo reagire l'acido monocloroacetico con l'etilendiammina, in presenza di acetato sodico.
Un secondo procedimento, oggigiorno più usato del precedente, consiste nel far reagire etilendiammina, aldeide formica e cianuro di sodio o acido cianidrico.
Il procedimento è fondato sulla seguente reazione:
H2NCH2CH2NH2 + 4 CH2O + 4 NaCN + 4 H2O → (NaO2CCH2)2NCH2CH2N(CH2CO2Na)2 + 4 NH3
Il sale sodico così ottenuto può essere facilmente convertito ad acido:
(NaO2CCH2)2NCH2CH2N(CH2CO2Na)2 + 4 HCl → (HO2CCH2)2NCH2CH2N(CH2CO2H)2 + 4 NaCl
Usi analitici dell'EDTA
L'uso principale dell'EDTA è come "sequestrante" di cationi metallici in chimica analitica.
L'EDTA forma infatti chelati molto stabili nel rapporto di 1:1 con quasi tutti i cationi metallici polivalenti, pertanto una mole di EDTA reagisce sempre con una mole di ione metallico.
Considerando il gran numero di elementi determinabili mediante titolazione con EDTA, si comprende la varietà delle tecniche che possono essere utilizzate per l'analisi.
Per titolazione diretta o attraverso una sequenza indiretta di reazioni, si possono determinare infatti con l'EDTA praticamente tutti gli elementi della tavola periodica.
Per individuare il punto finale nelle titolazioni con EDTA si possono utilizzare diversi metodi; la tecnica più comune però si basa sull'impiego di un indicatore metallocromico.
Un indicatore metallocromico è un composto il cui colore varia quando si lega a uno ione metallico; per essere utile un indicatore metallocromico deve legarsi al metallo più debolmente dell'EDTA.
Principali caratteristiche dell'EDTA
Di seguito sono riassunte le principali caratteristiche dell'EDTA:
- l'EDTA è il titolante complessometrico più utilizzato;
- considerato che l'acido è poco solubile, l'EDTA viene utilizzato come sale bisodico;
- l'EDTA è uno standard primario;
- l'EDTA forma complessi 1:1 con la maggior parte dei cationi metallici (tranne che con quelli del gruppo IA - metalli alcalini);
- i complessi che l'EDTA forma sono stabili e solubili in acqua.
Bisogna ricordare inoltre che nelle titolazioni con EDTA non è possibile operare a pH molto basici in quanto i cationi metallici precipiterebbero come idrossidi.
L'EDTA forma complessi stabili con i seguente cationi metallici:
Hg2+, Mg2+, Mn2+, Ni2+, Sr2+.
Cd2+, Ba2+, Ca2+, Fe2+, Fe3+.
Come avviene la formazione del complesso EDTA-catione metallico
Nel sale sodico dell'EDTA, gli ossigeni dei quattro gruppi carbossilici sono deprotonati e sono pertanto disponibili per formare legami ionici con il catione metallico.
Anche i due atomi di azoto dell'EDTA possiedono ciascuno una coppia di elettroni non condivisa, e tramite un legame dativo riescono a legare il catione metallico (nell'esempio di seguito lo ione Zn2+).
Si hanno così in totale sei punti di attacco e quindi l'EDTA è un legante esadentato.
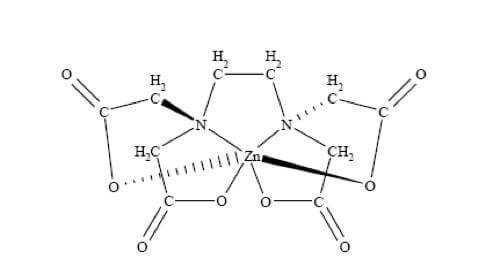
Complesso EDTA-catione metallico
Come è possibile notare dalla figura precedente, complessi che si formano (chelati) sono molto stabili in quanto formati da anelli a cinque atomi.
Esercizi sulle titolazioni complessometriche con EDTA
Se ti interessano li trovi qui: esercizi EDTA.
Link correlati:
Che cosa sono le diammine?
Studia con noi