Proteasoma
Che cos'è il proteasoma ?
Il proteasoma è un complesso multiproteico presente in tutte le cellule eucariotiche che ha la funzione di condurre in modo altamente regolato l'idrolisi ATP-dipendente di proteine intracellulari, non più utili o danneggiate, con emivita breve.
L'indirizzamento delle proteine ai proteasomi avviene a seguito di una marcatura con polimeri di ubiquitina, una proteina che, come indicato dal nome, è presente in tutti gli eucarioti e la cui sequenza è notevolmente conservata.
Nei procarioti, in particolare negli Archea, sono state rinvenute strutture omologhe del proteasoma, anche se non se ne conosce a pieno il ruolo fisiologico.
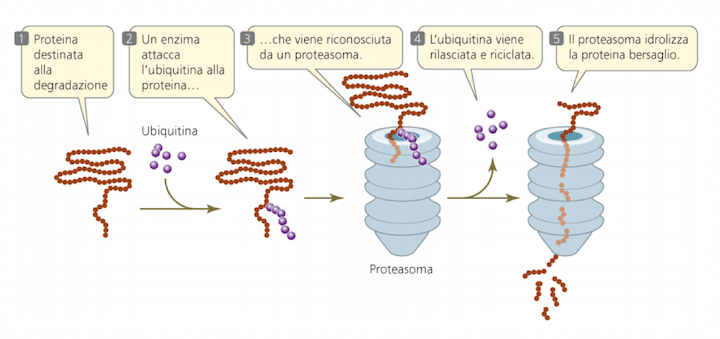
Tappe principali del processo di proteolisi proteasoma-dipendente.
Dimensioni e componenti del proteasoma
Il coefficiente di sedimentazione del proteasoma che si ottiene da esperimenti di centrifugazione in gradiente di densità appare essere di 26S, pertanto questa struttura cellulare è usualmente indicata come proteasoma 26S.
Il proteasoma è formato da due tipi di complessi multiproteici, una particella centrale 20S, ad attività catalitica e a forma di barile, detta nucleo, e una o due particelle regolatrici, ciascuna di 19S, poste a una o a entrambe le estremità del nucleo.
Da analisi di tipo chimico – fisico è emerso che il coefficiente di sedimentazione corretto del proteasoma è di 30S. La differenza rispetto alle tecniche di centrifugazione in gradiente di densità potrebbe essere dovuta alla presenza di una o due particelle regolatrici. Essendo, però, ancora incerta la reale organizzazione del proteasoma, esso continua ad essere preferibilmente indicato con le dimensioni di 26S.
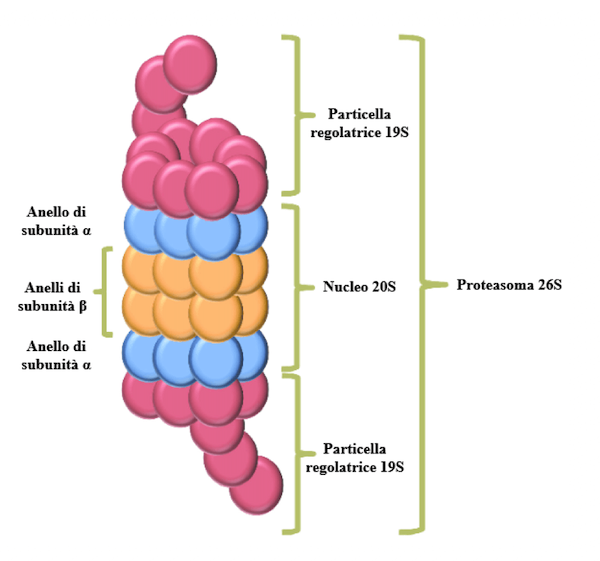
Struttura del proteasoma. Le particelle regolatrici possono essere in numero di uno o due.
Struttura del nucleo
Il nucleo è di 20S ed è costituito da quattro anelli, di cui quelli esterni contengono sette subunità α e quelli interni sette subunità β. A differenza dei proteasomi degli Archea, dove le subunità α e β sono tutte uguali, quelle degli eucarioti dono diverse isoforme derivate da fenomeni di duplicazione genica. In ogni anello interno, tre delle sette subunità β possiedono attività proteasica nei confronti di specifici substrati.
L'attività catalitica risiede, nello specifico, in residui di treonina presenti alle estremità N-terminali delle subunità β1, β2 e β5. Tali residui effettuano il taglio proteolitico con attacco nucleofilo al lato C-terminale di residui aminoacidici acidi, basici o idrofobici, mostrando, pertanto, un'attività simile, rispettivamente, agli enzimi caspasi, tripsina e chimotripsina.
Gli anelli di subunità α hanno delle cavità centrali quasi completamente chiuse, limitando e regolando il transito delle proteine da idrolizzare. Non è noto nei dettagli il meccanismo che porta all'apertura degli anelli di subunità α, ma sembra che il legame con proteine denaturate promuova questo processo.
All'interno del nucleo a forma di barile avviene la degradazione delle proteine in peptidi di 3-15 residui aminoacidici, poi degradati negli aminoacidi costituenti attraverso altre proteasi, alcune delle quali associate al proteasoma stesso.
Struttura della particella regolatrice
La particella regolatrice del proteasoma, di dimensioni 19S, può essere presente in una o due copie, poste a una o a entrambe le estremità del nucleo. Si compone di almeno 20 subunità, distinte in due gruppi, in base alla presenza o meno dell'attività ATP-asica.
Le subunità che non hanno attività ATP-asica, tra le varie funzioni, riconoscono le proteine ubiquitinate e rimuovono la catena di ubiquitina, mentre le ATPasi hanno il probabile ruolo di denaturare le proteine e indirizzarle all'interno del nucleo per la degradazione, contribuendo all'apertura degli anelli di subunità α. L'enzima che, nello specifico, ha la funzione di rimuovere il blocco di ubiquitina è detto isopeptidasi.
Coniugazione delle proteine bersaglio con l'ubiquitina
Le proteine la cui degradazione avviene attraverso il proteasoma devono essere prima legate a una catena di unità di ubiquitina.
Il legame ubiquitina – proteina bersaglio avviene mediante la formazione di un legame tra l'estremità C – terminale dell'ubiquitina e i gruppi ε – aminico di alcuni residui di lisina delle proteine bersaglio. Questo legame è definito isopeptidico, per distinguerlo dal normale legame peptidico che coinvolge i gruppi α – aminici degli aminoacidi.
L'unione di una sola unità di ubiquitina è un segnale molto debole per la degradazione, mentre una catena di quattro o più unità risulta essere più efficiente nell'indirizzare le proteine bersaglio al proteasoma. Anche le unità di ubiquitina solo legate tra loro mediante legami isopeptidici tra il gruppo ε – aminico di un residuo di lisina di una molecola e l'estremità C-terminale di un'altra.
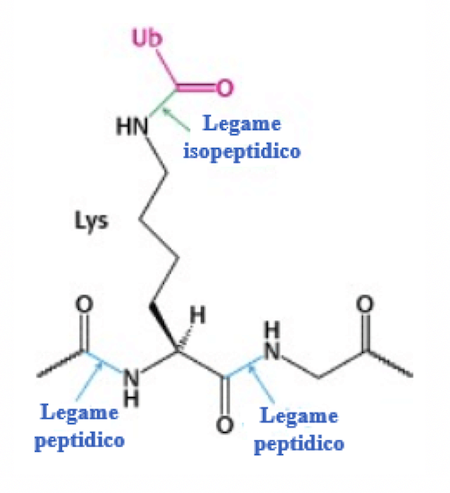
L'ubiquitina (Ub) è ancorata alle proteine da indirizzare ai proteasomi per la degradazione mediante la formazione di legami tra l'estremità C – terminale dell'ubiquitina e i gruppi ε – aminici di alcuni residui di lisina delle proteine bersaglio. Questi legami sono detti isopeptidici.
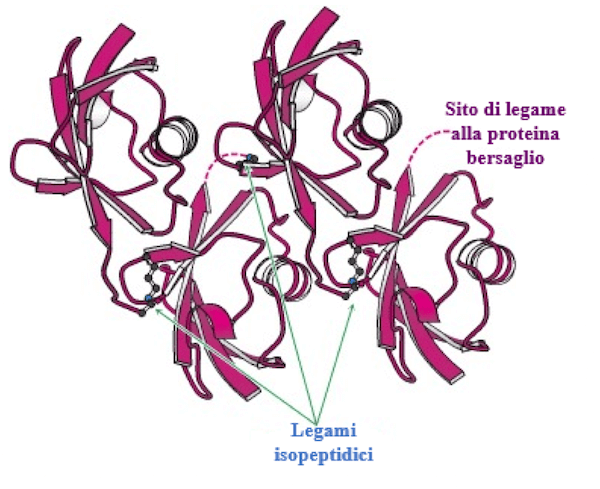
Gruppo di quattro unità di ubiquitina unite da legami isopeptidici. Catene di quattro o più unità di ubiquitina costituiscono segnali ottimali per la degradazione.
Enzimi coinvolti nel legame ubiquitina – proteine bersaglio
L'attacco della catena di ubiquitina alla proteina bersaglio avviene mediante il coinvolgimento di tre enzimi: l'enzima attivante dell'ubiquitina o E1, l'enzima di coniugazione dell'ubiquitina o E2 e la ligasi proteina – ubiquitina o E3.
In primo luogo, l'ubiquitina viene attivata mediante il legame a un gruppo adenilato all'estremità C-terminale. Questo processo comporta il rilascio di pirofosfato inorganico (PPi) e promuove il successivo trasferimento dell'ubiquitina al gruppo sulfidrilico di un residuo di cisteina dell'enzima E1, formando un legame tioestere.
Secondariamente, l'ubiquitina viene legata a un gruppo sulfidrilico dell'enzima E2 e, infine, l'enzima E3 trasferisce l'ubiquitina al residuo ε – aminico di un residuo di lisina della proteina bersaglio.
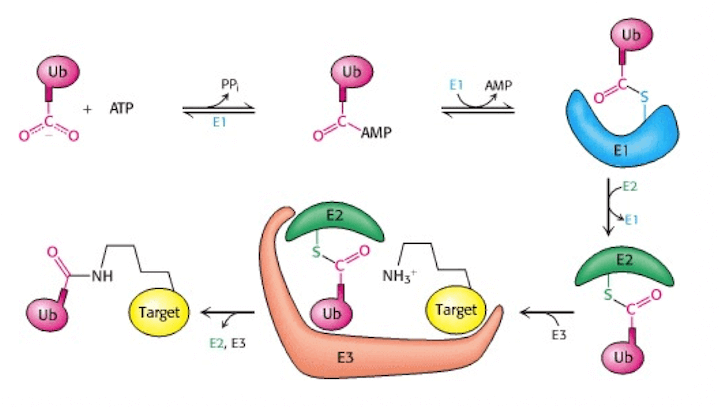
Coniugazione dell'ubiquitina alla proteina bersaglio (target nella figura). L'enzima E1 attiva l'ubiquitina mediante legame con un gruppo adenilato e rilascio di pirofosfato inorganico per poi realizzare un legame con il gruppo sulfidrilico di un residuo di cisteina dell'enzima stesso. Successivamente avviene il trasferimento su E2 e, infine, l'enzima E3 lega l'ubiquitina alla proteina bersaglio.
Segnali della degradazione delle proteine
L'ubiquitinazione delle proteine e l'indirizzamento al proteasoma per la degradazione dipende in larga misura dall'emivita delle proteine, a sua volta strettamente influenzata dai residui aminoacidi presenti alle estremità N – terminali.
Come dimostrato da studi condotti sui lieviti, alcuni residui aminoacidici, come la metionina o la prolina, conferiscono un'emivita piuttosto lunga, di più di 20 ore, preservando le proteine dalla degradazione mediante la via ubiquitina - proteasoma.
Altri aminoacidi, come l'arginina o la leucina, sono più destabilizzanti e l'emivita delle proteine può essere anche di soli 2 minuti perché l'ubiquitinazione avviene piuttosto rapidamente. Il riconoscimento dei residui aminoacidi alle estremità amino – terminali delle proteine bersaglio è un'ulteriore funzione dell'enzima E3.
Importanza della degradazione delle proteine
Un efficiente turnover delle proteine è essenziale per la corretta funzionalità delle cellule e la via ubiquitina – proteasoma rappresenta un sistema indispensabile sia per la regolazione di molti processi cellulari sia per l'eliminazione di proteine difettose.
Ad esempio, la distruzione delle cicline è essenziale per il corretto avanzamento del ciclo cellulare, mentre nei processi immunitari la via ubiquitina – proteasoma gioca un ruolo fondamentale nella modifica e nella presentazione degli antigeni MHC di classe I.
Altri meccanismi cellulari che dipendono da questa via di degradazione comprendono il metabolismo del colesterolo, la formazione degli organi, i ritmi circadiani, le risposte infiammatorie, la trascrizione genica e la soppressione tumorale.
Disfunzioni nella via ubiquitina – proteasoma, per inefficienza o eccessiva degradazione, sono alla base di diverse patologie: insorgenza tumorale, malattie renali, malattie neurodegenerative come Parkinson e Alzheimer, asma, fibrosi cistica e tante altre.
Link correlati:
Qual è la differenza tra cellule procariotiche ed eucariotiche?
Che cosa sono le cellule dendritiche?
Che cosa sono le cellule gliali?
Quali sono le differenze tra la cellula animale e la cellula vegetale?
Studia con noi