Elicasi
Che cosa sono le elicasi?
Le elicasi sono una classe di proteine diffusa in tutti gli organismi viventi la cui caratteristica è quella di essere in grado di separare un filamento di oligonucleotidi a doppia elica mediante consumo di ATP.
Sono quindi enzimi indispensabili per la replicazione del DNA, la trascrizione, la ricombinazione genica, la biogenesi dei ribosomi e la riparazione del DNA.
Durante la replicazione del DNA l'elicasi attacca l'acido nucleico iniziando a separare i due filamenti nell'Origine della replicazione e scorre lungo il filamento operando la progressiva apertura della molecola di DNA, dando origine ad una struttura a forca, detta forca di replicazione, in cui la polimerasi riesce legare il DNA a singolo filamento e sintetizzare il filamento complementare.
Oltre alle DNA-elicasi, esistono anche le RNA-elicasi, che partecipano a vari processi in cui è coinvolta la molecola di RNA, come trascrizione e splicing.
In presenza di DNA o RNA le elicasi sono stimolate nell'azione ATPasica, come effetto indiretto della propria funzione enzimatica. Questa caratteristica viene utilizzata per provare che una determinata molecola abbia attività di elicasi.
Storia
Le prime evidenze dell'esistenza di enzimi in grado di separare la doppia elica degli acidi nucleici furono riportate nel 1976 da Hoffmann e Berling dell'università di Heidelberg e da Mackay e Linn dell'Università della California. Questi ultimi descrissero la prima elicasi della storia identificando l'enzima ReBC in E.coli.
Da quel momento gli studi su questa classe di molecole divennero molto intensi e pochi anni dopo furono identificate alcune elicasi nei virus e nelle piante, ma ci vollero 10 anni per isolare la prima elicasi di mammifero.
Classificazione delle elicasi
Le elicasi si dividono in due grandi gruppi, in base alla direzione di progressione della propria attività lungo il filamento dell'acido nucleico: alcune elicasi viaggiano in direzione 3'- 5' e altre in maniera opposta.
Sebbene tutte le elicasi condividano un sito specifico per l'associazione con l'ATPasi da cui dipende il loro funzionamento, esiste una notevole variabilità nella struttura generale di questa grande famiglia di enzimi.
Sulla base della presenza di specifiche sequenze condivise, Gorbalenya e Koonin hanno proposto una classificazione che racchiude tutte le elicasi in sei grandi categorie (superfamiglie).
Le superfamiglie 1 e 2 sono complessi esamerici che formano degli anelli che avvolgono il singolo filamento di DNA, mentre le altre agiscono senza formare alcun anello.
La diversificazione delle elicasi è tale che nel genoma eucariotico circa l'1% dei geni codifica per proteine ad azione elicasica, con oltre 95 molecole differenti.
Elicasi esameriche
Le elicasi di tipo esamerico sono in grado di formare un anello che lega ed avvolge un singolo filamento di acido nucleico procedendo alla rottura progressiva dei legami a idrogeno tra i due filamenti.
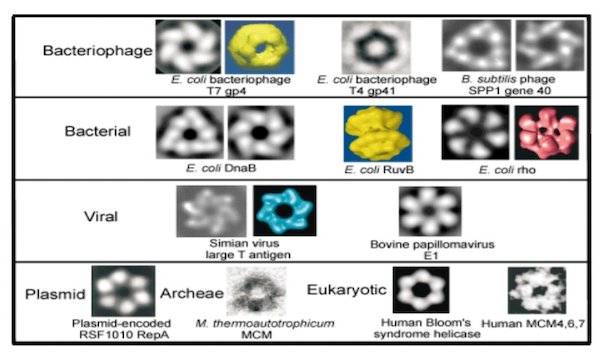
Alcune elicasi esameriche.
Nonostante le sequenze primarie siano variabili, tutte le elicasi esameriche presentano una struttura finale tridimensionale simile. Il processo di formazione dell'esamero e del legame con l'acido nucleico non è del tutto chiaro, ma pare evidente che tutte queste proteine necessitino, per comporre l'esamero, del legame con ioni Magnesio, Nucleotidi trifosfato (NTP) o entrambi. Il legame con NTP stimola la formazione dell'esamero, la quale a sua volta determina la capacità dell'enzima di legare il DNA.
Il legame dell'anello con il DNA stimola la capacità di idrolizzare l'ATP e l'idrolisi dell'ATP fornisce l'energia per la rottura dei legami idrogeno e lo scivolamento dell'enzima lungo il filamento di acido nucleico. La struttura ad anello è importante per garantire la necessaria processività dell'attività enzimatica.
Altri enzimi caratterizzati da elevata processività delle reazioni catalizzate presentano analogamente una struttura ad anello, come ad esempio alcune esonucleasi. Il singolo filamento di acido nucleico risulta completamente avvolto dall'anello, rimanendo posizionato nel canale che si forma nel suo centro. Questa conformazione garantisce la necessaria stabilità al processo.
Numerose malattie genetiche che causano gravi disturbi sono legate alla produzione di elicasi difettose che mancano della necessaria stabilità, rendendo i processi di trascrizione e traduzione poco efficienti.
Legame DNA-canale centrale nelle elicasi esameriche
È stato dimostrato che le elicasi che formano un anello legano il DNA nel canale centrale che si forma dall'unione delle sei subunità. Il DNA non interagisce però con tutti gli elementi dell'esamero, ma generalmente solo con uno o due di essi. Una eccezione è rappresentata dalla proteina Rho, una elicasi esamerica presente in Escherichia coli che lega il singolo filamento di RNA avvolgendolo esternamente intorno ai sei domini di legame specifici per questa molecola. Anche Rho, ad ogni modo, pare essere capace di legare l'RNA in un secondo sito specifico posizionato nel canale centrale.
Le modalità con cui il filamento di acido nucleico venga a trovarsi all'interno del canale centrale sono oggetto di investigazioni. I modelli proposti sono tre:
- l'anello si apre, permette l'inserimento del filamento nel canale ed infine si richiude;
- l'anello resta intatto e il filamento è reclutato e fatto scivolare all'interno del canale;
- la proteina si scompone nei sei monomeri, le unità che legano il filamento interagiscono con esso e la proteina si assembla nuovamente.
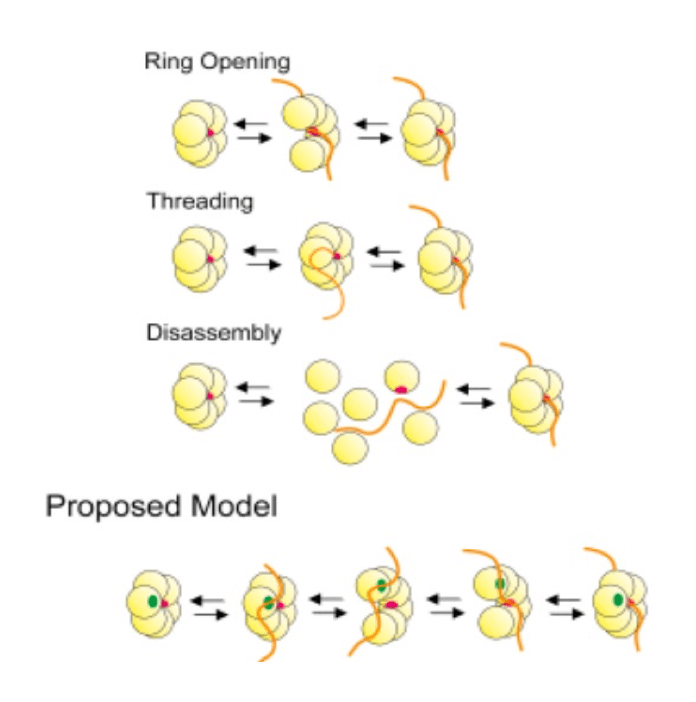
I tre possibili meccanismi di intrusione dell'acido nucleico nel canale centrale dell'elicasi.
Studi effettuati sulla proteina Rho di Escherichia coli suggeriscono che il legame DNA-enzima avvenga in un sito posizionato all'esterno dell'anello; successivamente a questa interazione la proteina si aprirebbe per consentire l'ingresso del filamento nel canale centrale e poi si richiuderebbe per dare inizio alla attività enzimatica. Altre elicasi esameriche utilizzano altri siti di legame esterni o sono coadiuvate, nella propria azione, da altre proteine.
La maggior parte delle elicasi è in grado di interagire solo se è presente uno starter di DNA o RNA a singolo filamento, alcune sono invece in grado di attaccare i duplex ancora pienamente formati. Sebbene sia noto che la proteina avvolga solo uno dei due filamenti nel canale, non è chiaro se vi siano interazioni esterne anche con l'altro filamento.
Il legame tra le elicasi esameriche e gli acidi nucleici è regolato dall'unione con i nucleotidi fosfato. L'ATP è il principale effettore nella maggior parte delle elicasi, ma anche altri nucleotidi di- o trifosfato possono legare i siti specifici dell'enzima. L'affinità per i nucleotidi di-fosfato è, tuttavia, molto minore.
Sebbene tutte le subunità presentino siti affini ai nucleotidi, si ritiene che solo tre di esse partecipino realmente al legame, mentre le altre tre presenterebbero siti a bassa affinità che non legano i nucleotidi. L'idrolisi degli NTP fornisce l'energia per lo scivolamento dell'enzima lungo il filamento secondo modalità non ancora definite.
Link correlati:
Che cos'è l'ecogenetica?
Che cos'è l'embriologia?
Studia con noi