Regola di Trouton
Esercizio sulla regola di Trouton
Applicando la regola di Trouton, si determini la temperatura di ebollizione del cicloesano sapendo che per questa sostanza l'entalpia di vaporizzazione è pari 31,3 kJ/mol.
Svolgimento dell'esercizio
L'esercizio propone il calcolo della temperatura di ebollizione del cicloesano sapendo che per questa sostanza l'entalpia di vaporizzazione è pari 31,3 kJ/mol.
La regola di Trouton afferma che, per un generico liquido, il rapporto tra l'entalpia molare di ebollizione (ΔHeb) e la temperatura di ebollizione Teb(espressa in kelvin) alla pressione atmosferica è un valore costante pari a circa 88 J/(mol K). In formula:
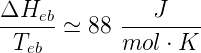
Il rapporto ΔHeb/Teb è detto entropia molare di ebollizione (ΔSeb) ed è una grandezza che esprime l'aumento di entropia dovuto al processo di ebollizione; questo termine è sempre positivo a causa dell'aumento del disordine di un sistema materiale quando questo passa dallo stato liquido (meno disordinato) allo stato aeriforme (molto disordinato).
La regola di Trouton non è valida per liquidi che:
- presentano legami ponte a idrogeno (come ad esempio l'acqua o l'etanolo);
- hanno punto di ebollizione molto alto e massa molare molto distante dal valore di 100 g/mol.
Tali condizioni, nel cicloesano, sono rispettate, infatti il cicloesano non forma legami a idrogeno e ha una massa molare di 84,16 g/mol che non si discosta in modo considerevole dal valore di 100 g/mol.
Per risolvere l'esercizio convertiamo entalpia molare di ebollizione (ΔHeb) in J/mol:
ΔHeb = 31,3 kJ/mol = 31300 J/mol
Sostituendo il valore del ΔHeb nella formula della regola di Trouton, si ha che:
31300 / Teb = 88
da cui:
Teb = 31300 / 88 = 356 K
Convertiamo la temperatura in gradi centigradi:
t = 356 - 273 = 83°C
Quindi, applicando al regola di Trouton, risulta che la temperatura di ebollizione del cicloesano alla pressione atmosferica è pari a 83°C.
Link correlati:
Esercizio svolto sull'equazione di Clausius–Clapeyron
Studia con noi