Esercizi di chimica analitica strumentale
Esercizi di chimica analitica strumentale in preparazione dell'Esame di Stato
In questa pagina del sito vengono proposti alcuni esercizi di chimica analitica strumentale, materia della seconda prova dell'Esame di Stato negli Istituti Tecnici Tecnologici.
Gli esercizi, risolti e commentati, riguardano le principali tecniche analitiche strumentali (quali ad esempio: assorbimento atomico, gascromatografia, HPLC, ecc.) e i relativi metodi di analisi (taratura diretta, retta di taratura, metodo dello standard interno, metodo dell'aggiunta multipla, ecc.).
Ti potrebbe interessare: esercizi sulla cromatografia su strato sottile, esercizi cromatografia di esclusione, esercizi spettrofotometria UV-VIS, esercizi sulla spettrofotometria di assorbimento atomico, esercizi sulla gascromatografia, esercizi sulla HPLC.
Gli esercizi seguenti sono raggruppati in base al metodo di analisi adottato.
Per svolgere i calcoli puoi utilizzare la calcolatrice scientifica presente nel sito.
Retta di taratura
#1
Si vogliono analizzare quantitativamente i nitriti presenti in un campione di acqua minerale utilizzando il metodo di Griess.
12,5 mL di campione di acqua minerale vengono prelevati e portati ad un volume di 50,0 mL. Dalla soluzione così ottenuta vengono prelevati 10,0 mL che vengono opportunamente trattati con il reattivo di Griess ed infine portati a 100,0 mL.
Se l'assorbanza della soluzione risultante è di 0,0963 e la retta di taratura ha equazione
y = 0,089 · X
in cui Y è l'assorbanza e X è la concentrazione del campione espressa in mg/L, si determini la concentrazione di ioni nitrito nella soluzione iniziale.
Lo svolgimento dell'esercizio lo trovi qui: esercizio sul metodo della retta di taratura.
#2
Si vuole determinare la concentrazione dei nitrati nell'acqua. Un campione di acqua di scarico, opportunamente trattato, ha dato un valore di assorbanza di A = 0,378.
Sapendo che la retta di taratura determinata sperimentalmente per la determinazione dell'azoto nitrico nelle acque ha la seguente equazione:
A = 0,080 · C
in cui:
- A = assorbanza;
- C = concentrazione in mgN · L-1
si determini la concentrazione dello ione nitrato (espresso in mgNO3-· L-1) nel campione di acqua di scarico.
Lo svolgimento dell'esercizio lo trovi qui: analisi dei nitrati nell'acqua tramite spettrofotometria UV-VIS.
Metodo dello standard interno
#1
Si vuole determinare la concentrazione di metanolo in un distillato alcolico con il metodo dello standard interno.
Sapendo che la miscela incognita è stata preparata utilizzando 10 mL di distillato e 10 mL di S.I. (a concentrazione 50 mg/L), si determini la concentrazione di metanolo nel campione espressa in mg/L.
Si sappia che:
1) la retta di taratura, ottenuta con le soluzioni standard, ha equazione y = 0,5 · x.
2) Le aree dei picchi del cromatogramma per la miscela incognita sono le seguenti:

Lo svolgimento dell'esercizio lo trovi qui: concentrazione di metanolo in un distillato alcolico.
#2
Per il dosaggio della isradipina in compresse è stato scelto il metodo dello standard interno utilizzando la molecola 56-81 come standard interno (S.I.).
Il cromatogramma ottenuto dall'analisi di una soluzione 0,090 M di isradipina (C) e 0,060 M di 56-81 (SI), indica che le aree dei picchi misurate in unità arbitrarie sono 420 per la isradipina (C) e 350 per lo standard interno (S.I.).
Per analizzare un campione incognito di isradipina, 10,0 mL di una soluzione 0,146 M di standard interno sono stati aggiunti a 10,0 mL della soluzione contenente la isradipina e la miscela è stata diluita a 25,0 mL in un matraccio tarato.
Dal cromatogramma ottenuto da questa soluzione, l'area del picco della isradipina è 549 e quella del picco dello standard interno è 610.
Determinare la concentrazione della isradipina nel campione di partenza.
Lo svolgimento dell'esercizio lo trovi qui: dosaggio della isradipina con il metodo dello standard interno.
#3
A 4,0 mL di un campione contenente isopropanolo (Is-OH) è stato aggiunto, come standard interno, 1,0 mL di butanolo (I.S.).
Il cromatogramma, ottenuto tramite analisi gascromatografica, presenta un picco per l'isopropanolo di area 204.000 (unità arbitrarie) e un picco per lo standard interno di area 510.000 (unità arbitrarie).
Il cromatogramma ottenuto dall'analisi di una soluzione standard ottenuta miscelando 0,500 mL di isopropanolo e 1,00 mL di butanolo (standard interno), indica che le aree dei picchi misurate in unità arbitrarie sono 324.000 per l'isopropanolo e 540.000 per lo standard interno (S.I.).
Si determini la percentuale in volume di isopropanolo nel campione sottoposto ad analisi.
Lo svolgimento dell'esercizio lo trovi qui: metodo dello standard interno in gascromatografia.
#4
Si vuole determinare la concentrazione di etanolo (EtOH) in un collutorio (Listerin) tramite GC utilizzando butanolo (ButOH) come Standard Interno.
Si prepara una soluzione standard aggiungendo 5 ml di ButOH a 10 mL di EtOH. Le aree dei picchi corrispondenti sono di 269,242 u.a. per il ButOH e 360,246 u.a. per il EtOH.
A 20 mL di collutorio viene aggiunto 1 mL di butanolo (corrispondente a un rapporto di 5+100, come quello usato per le soluzioni standard).
Le aree registrare corrispondono a 1906,78 per il EtOH e 676,435 per il ButOH.
Si determini:
1) l'equazione della retta di taratura
2) la concentrazione (in mL di EtOH/100 mL di collutorio) di EtOH nel collutorio
Lo svolgimento dell'esercizio lo trovi qui: concentrazione di etanolo in un collutorio.
Metodo dell'aggiunta multipla
#1
Si vuole determinare la concentrazione di rame in un campione mediante il metodo dell'aggiunta multipla.
Ad aliquote da 100 mL di un campione incognito, sono state effettuate aggiunte di uno standard a concentrazione nota (100 mg/L).
Considerando i valori riportati in tabella, si determini la concentrazione del rame nel campione.
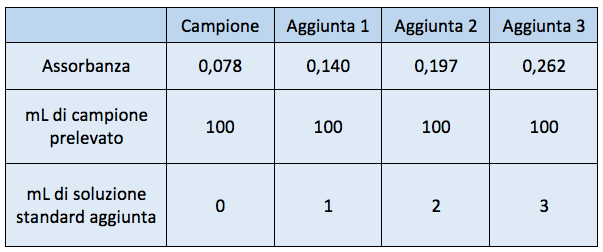
Lo svolgimento dell'esercizio lo trovi qui: esercizio sul metodo dell'aggiunta multipla.
Di seguito vengono invece riportati alcuni esercizi sulla preparazione di soluzioni standard. Vengono inseriti in questa pagina in quanto sono stati più volte proposti nella seconda prova dell'Esame di Stato.
Metodo della taratura diretta / metodo del confronto
#1
Per determinare la concentrazione della caffeina in una bevanda energetica, 50 mL del campione vengono concentrati a 5 mL e analizzati in HPLC. Si ottiene un picco di area A = 1800 unità arbitrarie (u.a.).
Nelle stesse condizioni operative una soluzione standard di caffeina (10 mg/L) ha fornito un picco di area A = 2400 u.a.
Si determini la concentrazione della caffeina nella bevanda energetica.
Lo svolgimento dell'esercizio lo trovi qui: concentrazione della caffeina in una bevanda energetica.
#2
Per l'analisi di tre componenti (A, B, C, non meglio specificati) presenti in un'acqua di scarico, si utilizza la cromatografia in fase liquida a elevate prestazioni (HPLC).
Allo scopo si prepara una soluzione standard a 5 ppm delle tre sostanze A, B e C.
L'analisi in HPLC, di tale soluzione, fornisce i seguenti risultati:
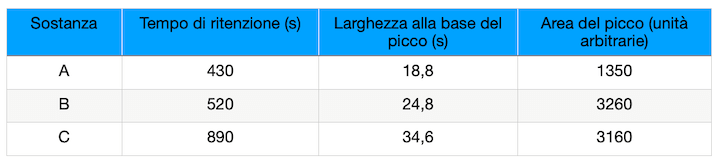
Calcolare la risoluzione tra i picchi.
200 mL del campione si estraggono con un opportuno solvente organico. L'estratto viene poi concentrato fino a 20,0 mL ed analizzato in HPLC nelle stesse condizioni sperimentali. Si ottiene un picco con tR = 522 s e area = 3920 unità arbitrarie.
Indicare se si tratta del composto A, B o C e determinare la sua concentrazione nel campione espressa in mg/L.
Lo svolgimento dell'esercizio lo trovi qui: analisi di un'acqua di scarico tramite HPLC.
#3
Si vuole determinare la concentrazione del rame in alcuni vini. Un vino ha fornito all'analisi spettrofotometrica in assorbimento atomico una assorbanza di 0,036.
Sapendo che nelle stesse condizioni sperimentali una soluzione standard a 0,5 mg/L di Cu fornisce un'assorbanza di 0,024, si determini la concentrazione in mg/L di Cu nel vino in esame.
Partendo da una soluzione madre a concentrazione 1000 mg/L, come è possibile preparare la soluzione standard a 0,5 mg/L di Cu?
Lo svolgimento dell'esercizio lo trovi qui: determinazione della concentrazione del rame in un vino.
#4
Un campione di acciaio di 1,09 g è stato solubilizzato e portato al volume di 500 mL. In seguito, 50 mL di questa soluzione sono stati diluiti a 500 mL. Infine, 20 mL di quest'ultima soluzione sono stati ulteriormente diluiti (1 + 4). La soluzione finale così preparata fornisce un'assorbanza di 0,360.
Sapendo che nelle stesse condizioni sperimentali una soluzione standard a 5,0 mg/L di Cr fornisce un'assorbanza di 0,378, si determini la percentuale in massa di Cr nel campione di acciaio.
Lo svolgimento dell'esercizio lo trovi qui: determinazione del cromo tramite spettrofotometria di assorbimento atomico.
Metodo della normalizzazione interna con fattore di risposta
#1
Una miscela standard di tre componenti: A (20%), B (30%), C (50%) ha fornito, in un'analisi al gascromatografo, le seguenti aree: SA = 3500 mm2, SB = 5500 mm2, SC= 6000 mm2.
L'analisi cromatografica di una miscela incognita degli stessi componenti, svolta nelle stesse condizioni sperimentali, ha fornito invece le seguenti aree: S'A = 4500 mm2, S'B = 6500 mm2, S'C= 5000 mm2.
Si determini la composizione percentuale della miscela.
Lo svolgimento dell'esercizio lo trovi qui: esercizio sulla normalizzazione interna con fattore di risposta.
Preparazione di soluzioni standard
#1
Si eseguano i calcoli necessari per preparare soluzioni standard diluite con concentrazione compresa tra 1 e 5 ppm, ognuna del volume di 50 mL, utilizzando una soluzione standard a concentrazione 1000 ppm.
Lo svolgimento dell'esercizio lo trovi qui: preparazione di soluzioni standard.
#2
Si vuole determinare il contenuto di un metallo in una lega tramite assorbimento atomico di fiamma (AAF).
Allo scopo si prepara una soluzione trattando opportunamente 0,1958 g di lega. Tale soluzione si porta a volume in un matraccio tarato da 100 mL.
Sapendo che il campione contiene circa il 90% dell'analita e che l'intervallo di linearità ricade tra 2 e 10 ppm, si eseguano i calcoli necessari per preparare cinque soluzioni standard diluite, ognuna del volume di 100 mL, partendo da una soluzione standard a 1000 ppm del metallo.
Determinare inoltre quale potrebbe essere una diluizione adeguata della soluzione del campione per effettuare l'analisi.
Lo svolgimento dell'esercizio lo trovi qui: esercizio sulla preparazione di soluzioni standard diluite.
Studia con noi