Concentrazione ioni acetato
Calcolo della concentrazione degli ioni aceto in una soluzione che contiene sia acido acetico che acido cloridrico
Si calcoli la concentrazione di ioni acetato in una soluzione che sia contemporaneamente 0,2 M in acido acetico che 1,8·10-2 M in HCl.
Si sappia che per l'acido acetico Ka = 1,8 · 10-5.
Svolgimento dell'esercizio
La soluzione in questione contiene sia acido acetico (CH3COOH) che acido cloridrico (HCl); tali acidi si dissociano nei seguenti modi:
CH3COOH ⇆ CH3COO− + H+
HCl → H+ + Cl−
È necessario inoltre notare che mentre l'acido acetico è un acido debole, l'acido cloridrico è un acido forte.
L'espressione della costante acida per la ionizzazione dell'acido acetico è la seguente:
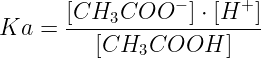
Se indichiamo con X la concentrazione di acido acetico che si ionizza, ad equilibrio raggiunto, si ha che:
[CH3COOH] = 0,2 - X
[CH3COO−] = X
Per quanto riguarda invece la [H+] presente in soluzione, bisogna tenere conto sia del contributo dell'acido acetico (pari al valore X) sia del contributo dell'acido cloridrico che, essendo un acido forte e quindi completamente ionizzato, contribuisce con 1,8·10-2 mol/L.
La [H+] totale presente in soluzione è quindi pari alla somma dei due contribuiti ed è quindi:
[H+] = 1,8·10-2 + X
Riassumendo:
- [CH3COOH] = 0,2 - X
- [CH3COO−] = X
- [H+] = 1,8·10-2 + X
Il valore X può essere trascurato sia nell'espressione della concentrazione di acido acetico che nell'espressione della concentrazione dello ione H+; ciò in quanto l'acido acetico è un acido debole (e quindi il valore X è molto piccolo) e anche in ragione del fatto che la presenza di acido acetico spinge a sinistra l'equilibrio CH3COOH ⇆ CH3COO− + H+ (per info si veda: effetto dello ione comune).
Pertanto le concentrazione delle specie chimiche all'equilibrio possono essere così semplificate:
- [CH3COOH] = 0,2
- [CH3COO−] = X
- [H+] = 1,8·10-2
Sostituendo i dati nell'espressione della costante acida dell'acido acetico si ha che:
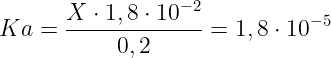
Ricaviamo infine il valore di X:
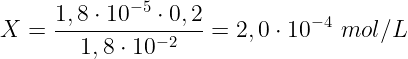
In conclusione, la concentrazione di ioni acetato nella soluzione è pari a 2,0 · 10-2 mol/L.
Link correlati:
Esercizi online e gratuiti sul pH e sul pOH
Studia con noi