Ibridazione sp2
Ibridazione sp2 del carbonio
La configurazione elettronica dell'atomo di carbonio allo stato fondamentale è 1s2 2s2 2p2.
Essendovi solo 2 elettroni spaiati e tenendo conto che per la regola di Hund i 2 elettroni p devono occupare 2 degli orbitali degeneri p (degeneri = aventi la stessa energia), il carbonio dovrebbe essere in grado di formare unicamente due legami.
Per giustificare la formazione di 4 legami si deve ammettere che un elettrone dell'orbitale 2s venga "promosso" all'orbitale 2p vuoto: ciò avviene con assorbimento di una considerevole quantità di energia.
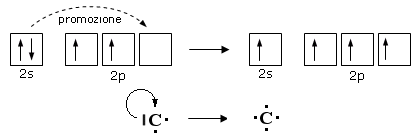
Nel caso della formazione di quattro legami covalenti, siccome l'orbitale atomico 2s sferico ha energia inferiore e forma diversa da quella dei tre orbitali 2p (2px, 2py, 2pz), dovremmo aspettarci la formazione di tre legami uguali ed uno diverso; l'equivalenza degli atomi di H nella molecola del metano (CH4) richiede invece che i 4 legami siano uguali e quindi che siano uguali i 4 orbitali impegnati in questi legami.
Secondo L. Pauling ciò può essere spiegato ammettendo una fusione e ridistribuzione di cariche chiamata ibridazione.
La teoria suggerisce il "mescolamento" dell'orbitale 2s con i tre orbitali 2p: tale mescolamento porta alla formazione di quattro orbitali ibridi sp3 (per info: ibridazione sp3).
Come avviene l'ibridazione sp2?
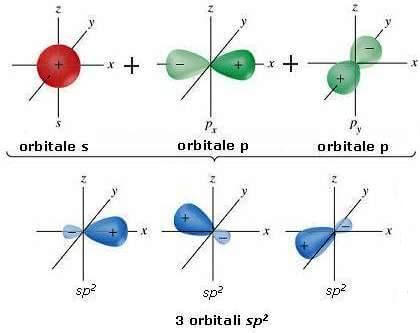
Nell'atomo di carbonio allo stato eccitato può avvenire anche l'ibridazione dell'orbitale s con 2 soli orbitali p; il terzo orbitale p rimane quindi inalterato.
Ibridando l'orbitale s con 2 orbitali p si ottengono 3 orbitali ibridi identici tra loro: i nuovi 3 orbitali ibridi, chiamati sp2, hanno per ⅓ le caratteristiche dell'orbitale s di partenza e per ⅔ le caratteristiche degli orbitali 2p.
Nella dicitura sp2 il 2 esponente di p indica il numero di orbitali p che partecipano alla formazione dell'ibrido. La forma di ciascun orbitale ibrido sp2 è la seguente:

Forma dell'orbitale sp2.
Il lobo di dimensione maggiore è quello che viene utilizzato nei legami. Talvolta, per questioni di praticità, non si rappresenta il lobo di dimensione minore.
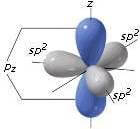
I 3 orbitali ibridi sp2 sono trigonali, giacenti su un piano e formanti fra di loro angoli di 120°. Tale disposizione è spiegata dalla teoria VSEPR: secondo tale teoria, le coppie di elettroni più esterne, avendo tutte la stessa carica negativa, tendono a respingersi le une con le altre e a disporsi il più lontano possibile.
L'orbitale p è invece disposto perpendicolarmente al piano su cui giacciono i tre orbitali ibridi sp2.
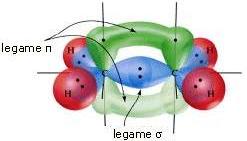
Se due atomi di carbonio ibridati sp2 uniscono un orbitale ibrido (con legame σ) e sono orientati in maniera da avere gli orbitali p paralleli, si forma un secondo legame tra tali orbitali (legame π). I due legami, come i dati sperimentali confermano, non sono equivalenti.
Nella molecola dell'etilene (H2C=CH2) i restanti orbitali sp2 (due per ogni atomo di carbonio) si sovrappongono con gli orbitali 1s, di forma sferica, appartenenti ai quattro atomi di idrogeno, formando ulteriori quattro legami σ.
Per una conveniente rappresentazione prospettica si può orientare la molecola in modo da disporre sul piano del foglio il legame σ carbonio-carbonio e il legame π (formanti assieme il "doppio legame"); gli altri quattro legami σ (legami C-H) giacciono su un piano perpendicolare a quello del foglio.
Più comodo è però orientare la molecola con i cinque legami σ sul piano del foglio; il legame π in tal caso sarà anteriore e posteriore al foglio, ma tale particolarità non è interessante e non viene indicata.
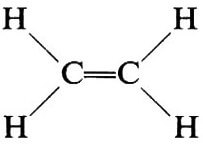
Qualora invece avvenga l'ibridazione dell'orbitale s con un solo orbitale p, si ottengono due orbitali ibridi sp (per info: ibridazione sp2).
Link correlati:
Ibridazione dell'atomo di azoto
Studia con noi