Stechiometria
Di cosa si occupa la stechiometria?
La stechiometria (greco στοιχεῖον "elemento" e μέτρον "misura") è lo studio dei rapporti quantitativi (ovvero dei rapporti ponderali, che riguardano cioè il peso) fra le sostanze che entrano a far parte di una reazione chimica; tale studio si basa sulla conoscenza delle leggi fondamentali della chimica quali la legge di Lavoisier, la legge di Proust e la legge di Dalton.
L'intuizione dell'esistenza in natura di rapporti definiti e spesso esprimibili in numeri interi non è nuova, ma piuttosto recente è la riprova sperimentale nel campo chimico: C. F. Wenzel già nel 1777 espresse i risultati analitici sulla neutralizzazione reciproca degli acidi e delle basi in rapporti numerici.
L'esistenza della stechiometria chimica, cioè la possibilità di considerare gli schemi ponderali delle reazioni come vere e proprie equazioni, è espressa in modo chiarissimo nella memoria di A. L. Lavoisier sull'ossidazione del ferro; un contributo essenziale alla definizione della stechiometria fu poi dato successivamente nel 1792 da J. B. Richter.
Stechiometria di una reazione chimica
La stechiometria di una reazione chimica indica in quali rapporti due o più sostanze reagiscono tra di loro. In una equazione chimica la stechiometria della reazione viene espressa mediante opportuni coefficienti detti appunto coefficienti stechiometrici che precedono le formule chimiche delle sostanze coinvolte nella reazione.
Tali coefficienti indicano i rapporti molari con cui le sostanze coinvolte nella reazione chimica reagiscono tra loro; altresì indicano in quali rapporti, sempre in moli, le sostanze prodotte si vengono a formare. Il calcolo stechiometrico permette pertanto di determinare quantitativamente le moli di reagenti e di prodotti coinvolte in una reazione chimica.
Consideriamo ad esempio la seguente equazione chimica relativa alla combustione del metano:
![]()
nella quale in rosso vengono indicati i reagenti (scritti a sinistra della freccia) mentre in verde vengono scritti i prodotti (a destra della freccia).
I coefficienti stechiometrici sono:
- 1 per il CH4 (metano);
- 2 per l'O2 (ossigeno);
- 1 per la CO2 (anidride carbonica);
- 2 per H2O (acqua).
Tale equazione chimica ci indica che una mole di CH4 reagisce con due moli di O2; i rispettivi coefficienti stechiometrici sono infatti 1 e 2.
Ricordando che una mole di CH4 (massa molare = 16 g/mol) corrisponde a 16 grammi e che due moli di ossigeno (MM = 32 g/mol) corrispondono a 64 grammi, risulta che metano e ossigeno reagiscono nel rapporto in grammi di 16 a 64.
Consideriamo ora i prodotti della reazione. L'equazione chimica bilanciata ci indica che per una mole di CO2 che si forma se ne formano due di H2O.
Ricordando che una mole di CO2 (massa molare = 44 g/mol) corrisponde a 44 grammi e che due moli di H2O (MM = 18 g/mol) corrispondono a 36 grammi, risulta che CO2 e H2O si formano nel rapporto in grammi di 44 a 36.
Concludendo: 16 g di CH4 reagiscono con 64 g di O2 per formare 44 g di CO2 e 36 g di H2O.
Come è possibile notare dalle quantità delle sostanze reagite e prodotte è pienamente rispettata la legge di Lavoisier: in una reazione chimica, la somma delle masse dei reagenti (16 g di CH4 + 64 g di O2 = 80,0 g) è uguale alla somma delle masse dei prodotti (44 g di CO2 + 36 g di H2O = 80,0 g).
Esempio di calcolo
Data la seguente equazione chimica:
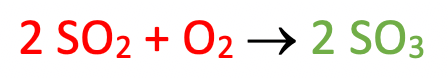
Determinare quanti grammi di O2 reagiscono con 6,4 g di SO2 e quanti grammi di SO3 si formano.
Svolgimento dell'esercizio
Come detto in precedenza i coefficienti stechiometrici (nel nostro caso 2, 1, 2) indicano in quale rapporto in moli reagenti e prodotti sono coinvolti nella reazione chimica. La prima cosa da fare è quindi convertire la massa di SO2 in moli.
A tale scopo dividiamo la massa in grammi per il valore della massa molare di SO2 (MM = 64,0 g/mol):
nSO2 = g / MM = 6,4 / 64,0 = 0,1 mol
SO2 e O2 reagiscono nel rapporto di 2 : 1. Per determinare le moli di O2 che reagiscono con 0,1 mol di SO2, impostiamo la seguente equazione chimica:
2 : 1 = 0,1 : X
Da cui:
X = 0,05 mol
Convertiamo le moli di O2 (MM = 32,0 g/mol) in grammi:
mO2 = n ∙ MM = 0,05 ∙ 32 = 1,6 g
Determiniamo ora la massa di SO3 prodotta. Per 2 moli di SO2 reagite si formano 2 moli di SO3, quindi la proporzione da impostare è la seguente:
2 : 2 = 0,1 : X
Da cui:
X = 0,1 mol
Convertiamo infine le moli di SO3 (MM = 80,0 g/mol) in grammi:
mSO3 = n ∙ MM = 0,1 ∙ 80,0 = 8,0 g
Link correlati:
Esercizi online e gratuiti di stechiometria
Esercizi svolti sulla mole
Come si convertono le moli in grammi
Cosa si indica in chimica con il simbolo n?
Quante moli di acqua ci sono in un litro di acqua?
Studia con noi