Reazioni elettrodiche e fem di una pila
Reazioni elettrodiche e calcolo della fem di una pila influenzata dal pH
Indicare le semireazioni elettrodiche e calcolare la fem della seguente pila a 25°C:
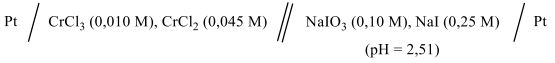
Si sappia che:
E°(Cr3+/Cr2+) = -0,41 V e E°(IO3−/I−) = 1,085 V.
Svolgimento dell'esercizio
L'esercizio propone il calcolo della fem di una pila e l'individuazione delle due reazioni che avvengono agli elettrodi.
Per la risoluzione dell'esercizio è necessario scrivere le due semireazioni di riduzione, calcolare i rispettivi potenziali di riduzione applicando l'equazione di Nernst (noti i potenziali standard di riduzione, le concentrazioni, il pH e la temperatura) e calcolare la fem della pila ricordando che: fem = Ecatodo - Eanodo.
All'anodo avviene la seguente reazione (scritta come semireazione di riduzione):
Cr3+ + e− →Cr2+
il cui potenziale di riduzione vale:
![]()
Pertanto Eanodo = -0,45 V
Al catodo avviene la seguente reazione di semireazione:
6H+ + 6e− + IO3− → I− + 3 H2O
il cui potenziale di riduzione vale:
![]()
infatti si ha che:
- pH = 2,51, da cui [H+] = 10-2,51 = 3,09 · 10-3 mol/L (per info: da pH a concentrazione ioni H+).
Pertanto Ecatodo = 0,93 V
Calcoliamo infine la fem della pila:
fem = Ecatodo - Eanodo = 0,93 - (- 0,45) = 0,93 + 0,45 = 1,38 V
Ti proponiamo un esercizio molto simile a quello appena svolto: fem di una pila e semireazione influenzata dal pH.
Link correlati:
Calcolo della fem di una pila la cui semireazione è influenzata dal pH
Calcolo del potenziale della semireazione Cl2(g) + 2 e- → 2 Cl-
Esercizio sul calcolo della fem di una pila e della Keq
Studia con noi