Esercizi sul primo principio termodinamica
Esercizi online e gratuiti sul primo principio della termodinamica
Vengono di seguito propost alcuni esercizi sul primo principio della termodinamica.
La raccolta degli esercizi sul primo principio della termodinamica di seguito proposta è rivolta sia agli studenti universitari delle facoltà scientifiche che agli studenti di licei ed istituti tecnici.
Prima di affrontare gli esercizi sul primo principio della termodinamica facciamo una breve introduzione all'argomento.
Il primo principio della termodinamica afferma che affinché si abbia variazione dell'energia interna di un sistema, questo deve scambiare energia con l'esterno.
Ogni scambio di energia fra un sistema e l'esterno avviene o tramite lavoro o per passaggio di calore.
Quindi: un sistema può variare il proprio contenuto di energia solo attraverso scambi di calore e di lavoro con l'ambiente.
Pertanto:
ΔU = Q - L
in cui:
ΔU = variazione di energia interna subita dal sistema durante la trasformazione;
Q = quantità di calore scambiata con l'ambiente;
L = lavoro in gioco nella trasformazione.
Il calore Q è positivo se passa dall'ambiente al sistema mentre è negativo e viene ceduto dal sistema; Il lavoro L invece è positivo se compiuto dal sistema mentre è negativo se è compiuto dall'ambiente sul sistema.
Ti mettiamo inoltre disposizione una calcolatrice online e gratuita utile per svolgere i calcoli degli esercizi: calcolatrice scientifica.
Esercizi sul primo principio della termodinamica
Di seguito gli esercizi sul primo principio della termodinamica elencati secondo un ordine crescente di difficoltà.
Livello di difficoltà medio-basso
1.
Un sistema termodinamico costituito da 2 moli di un gas perfetto monoatomico assorbe una quantità di calore dall'esterno pari a 10 calorie e compie un lavoro meccanico di 10 J.
Quanto vale la variazione di energia interna del sistema ?
Quale sarà la variazione di temperatura ?
Lo svolgimento dell'esercizio lo trovi qui: calcolo della variazione di energia interna.
2.
2,5 moli di un gas biatomico contenuto all'interno di un pistone mobile si espande alla pressione di 1,5 atm passando da un volume iniziale di 300 dm3 a un volume finale doppio.
Calcola il lavoro, il calore e la variazione di energia interna specificando se calore e lavoro sono rispettivamente acquisiti/ceduti o eseguiti/subiti dal gas sull'ambiente.
Lo svolgimento dell'esercizio lo trovi qui: esercizio su una trasformazione isobarica.
Livello di difficoltà medio-alto
3.
Un cilindro munito di pistone contiene 1000 dm3 di un gas perfetto che si trova inizialmente a pressione atmosferica.
Il gas viene compresso isotermicamente fino a raggiungere un volume pari a 400 dm3.
Calcolare il lavoro della trasformazione e specificare se è subito dal gas o eseguito da esso sull'ambiente esterno.
Lo svolgimento dell'esercizio lo trovi qui: esercizio su una compressione isotermica.
4.
2 moli di un gas compiono un ciclo composto tra una trasformazione isocora, seguita da una isoterma, una isocora ed una isoterma ancora che lo riporta allo stato iniziale, secondo questo schema:
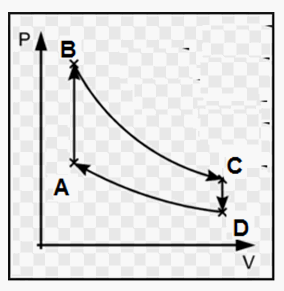
In cui:
A → B = isocora
B → C = isoterma
C → D = isocora
D → A = isoterma
Sapendo che:
PA = 2 · 105 Pa
PB = 4 · Pa
PC = 2,285 · 105 Pa
PD = PC /4
TA = 122 K
TB = 4 · TA
TC = 4 · TA
TD = TA
Calcolare il calore ceduto o acquisito dal gas durante l'intero ciclo.
Lo svolgimento dell'esercizio lo trovi qui: ciclo termodinamico chiuso.
5.
4 moli di un gas perfetto biatomico descrivono le seguenti trasformazioni:
A → B = isoterma
B → C = isocora
C → D = isobara
D → E = adiabatica
Essendo noti:
VA = 10 l
VB = 20 l
VD = 40l
PA = 8,21 atm
PC = 8,21 atm
PE = 16,42 atm
Determinare:
- i parametri termodinamici (P, V e T) per ogni singolo stato A, B, C, D ed E
- il lavoro, il calore e la variazione di energia interna legati ad ogni singola trasformazione.
Lo svolgimento dell'esercizio lo trovi qui: trasformazioni termodinamiche di un gas perfetto biatomico.
Studia con noi