Trasformazioni termodinamiche di un gas perfetto biatomico
Trasformazioni termodinamiche di un gas perfetto biatomico, esercizio svolto
4 moli di un gas perfetto biatomico descrivono le seguenti trasformazioni:
A → B = isoterma
B → C = isocora
C → D = isobara
D → E = adiabatica
Essendo noti:
VA = 10 l
VB = 20 l
VD = 40l
PA = 8,21 atm
PC = 8,21 atm
PE = 16,42 atm
Determinare:
- i parametri termodinamici (P, V e T) per ogni singolo stato A, B, C, D ed E
- il lavoro, il calore e la variazione di energia interna legati ad ogni singola trasformazione.
Svolgimento
Il gas presentato dal problema subisce quattro trasformazioni termodinamiche: isoterma, isocora, isobara ed adiabatica.
Determiniamo per prima cosa pressione, volume e temperatura per ogni stato.
Dello stato A conosciamo la pressione ed il volume:
VA = 10 l = 10 · 10-3 m3 = 10-2 m3
PA = 8,21 atm = 8,21 · 105 Pa
Sfruttando l'equazione di stato dei gas perfetti:
PA · VA = n · R · TA
ricaviamo la temperatura TA:
TA = PA · VA / (n · R) = (10-2 · 8,21 · 105) / (4 · 8,314) = 247 K
Dello stato B ci viene fornito solo il volume pari a:
VB = 20 l = 20 · 10-3 m3
Sapendo però che la trasformazione AB è una isoterma, possiamo affermare che
TA = TB = 247 K
La pressione in B è dunque ricavabile attraverso l'equazione di stato:
PB · VB = n · R · TB
ricaviamo la pressione PB:
PB = (n · R · TB) / VB = (4 · 8,314 · 247) / ( 20 · 10-3) = 4,1 · 105 Pa
Dello stato C conosciamo la pressione:
PC = 8,21 atm = 8,21 · 105 Pa
Sfruttando il fatto che la trasformazione BC è una isocora, in cui il volume si mantiene costante, possiamo scrivere che:
VB = VC = 20 · 10-3 m3
ricaviamo la temperatura TC dall'equazione di stato:
TC = (PC · VC) / (n · R) = (8,21 · 105 · 20 · 10-3) / (4 · 8,314) = 494 K.
Dello stato D conosciamo il volume:
VD = 40 l = 40 · 10-3 m3
inoltre essendo CD una isobara:
PC = PD = 8,21· 105 Pa
ricaviamo la temperatura TD dall'equazione di stato:
TD = (PD · VD) / (n · R) = (8,21 · 105 · 40 · 10-3) / (4 · 8,314) = 987 K.
Infine consideriamo lo stato E:
PE = 16,42 atm = 16,42 · 105 Pa
La trasformazione DE è adiabatica per cui vale che:
PD · VDλ = PE · VEλ
in cui λ è il rapporto tra i calori specifici molari a pressione e a volume costante che per un gas biatomico vale 7/5.
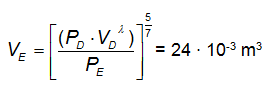
ricaviamo la temperatura TE dall'equazione di stato:
TE = (PE · VE) / (n · R) = (16,42 · 105 · 24 · 10-3)/ (4 · 8,314) = 1185 K
Per cui ricapitolando abbiamo:
VA = 10-2 m3
PA = 8,21 · 105 Pa
TA = 247 K
VB = 20 l = 20 · 10-3 m3
TB = 247 K
PB = 4,1 · 105 Pa
PC = 8,21 · 105 Pa
Vc = 20 · 10-3 m3
TC = 494 K
VD = 40 · 10-3 m3
PD = 8,21· 105 Pa
TD = 987 K
PE = 16,42 · 105 Pa
VE = 24 · 10-3 m3
TE = 1185 K
Calcoliamo adesso lavoro, calore e variazione di energia interna legati ad ogni singola trasformazione.
Partiamo dalla trasformazione AB isoterma.
In una trasformazione isoterma l'energia interna rimane costante, per cui il calore Q scambiato è uguale al lavoro fatto dal gas:
ΔUAB = 0
QAB = LAB
ed in particolare il lavoro tra lo stato iniziale (A) e finale (B) vale:
LAB = n· R · TA · ln (VB / VA) = 4 · 8,314 · 247 · ln (2) = 5694 J
La trasformazione BC è isocora; in una trasformazione a volume costante la variazione di energia interna è pari al calore scambiato nella trasformazione.
ΔUBC = QBC
In una trasformazione isocora il calore può essere calcolato come:
QBC = Cv · n · ΔT
in cui Cv è il calore specifico a volume costante, n il numero di moli e ΔT la variazione di temperatura.
QBC = Cv · n · ΔT = 5/2 · R · 4 · (494 - 247) = 20536 J
La trasformazione CD è isobara; in una trasformazione a pressione costante il calore può essere calcolato come:
QCD = Cp · n · ΔT
in cui Cp è il calore specifico a pressione costante, n il numero di moli e ΔT la variazione di temperatura
QCD = Cp · n · ΔT = 7/2 · R · 4 · (987 - 494) = 57383 J
Il lavoro compiuto gas vale invece:
LCD = PC · ΔV = 8,21· 105 · (40 - 20) · 10-3 = 16420 J
e per il primo principio della termodinamica:
ΔUCD = QCD - LCD = 57383 - 16420 = 40963 J
Infine la trasformazione DE è adiabatica ovvero è una trasformazione in cui non c'è scambio di calore (QDE = 0)
In una trasformazione adiabatica, la variazione di energia interna ΔU è opposta al lavoro fatto dal gas.
ΔUDE = - LDE
Poiché il gas è biatomico risulta:
ΔUDE = 5/2 · n · R · ΔT = 5/2 · 4 · 8,314 · (1185 - 987) = 16462 J
In definitiva ricapitolando:
ΔUAB = 0
QAB = 5694 J
LAB = 5694 J
ΔUBC = 20536 J
QBC = 20536 J
LBC = 0 J
QCD = 57383 J
LCD = 16420 J
ΔUCD = 40963 J
QDE = 0
ΔUDE = 16462 J
LDE = - 16462 J
Studia con noi