Ciclo termodinamico chiuso
Esercizio su ciclo termodinamico chiuso
2 moli di un gas compiono un ciclo composto tra una trasformazione isocora, seguita da una isoterma, una isocora ed una isoterma ancora che lo riporta allo stato iniziale, secondo questo schema:
A → B = isocora
B → C = isoterma
C → D = isocora
D → A = isoterma
Sapendo che
PA = 2 · 105 Pa
PB = 4 · Pa
PC = 2,285 · 105 Pa
PD = PC /4
TA = 122 K
TB = 4 · TA
TC = 4 · TA
TD = TA
Calcolare il calore ceduto o acquisito dal gas durante l'intero ciclo.
Svolgimento
Il problema propone un ciclo termodinamico chiuso compiuto da un gas che parte da uno stato A e dopo 4 trasformazioni torna allo stato iniziale.
Possiamo rappresentare in un piano P-V le quattro trasformazioni come di seguito:
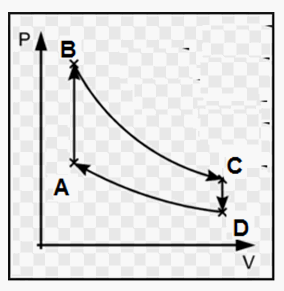
Innanzitutto trattandosi di un ciclo in cui lo stato iniziale e finale coincidono, la variazione di energia interna è nulla, per cui:
ΔU = 0
Quindi per il primo principio della termodinamica:
ΔU = Q - L = 0
Q = L
Ovvero il calore scambiato durante l'intero ciclo è uguale al lavoro.
Ora il lavoro relativo all'intero ciclo è dato dalla somma dei lavori legati alle singole trasformazioni:
L = LA→B + LB→C + LC→D + LD→A
in cui
A → B = isocora
B → C = isoterma
C → D = isocora
D → A = isoterma
Ora sappiamo che per una trasformazione isocora il lavoro è nullo per cui risulta immediatamente che:
LA→B = LC→D = 0
In una trasformazione isoterma il lavoro tra lo stato iniziale (1) e finale (2) vale:
L12 = n · R · T · ln (V2 / V1) = n · R · T· ln (P1/P2)
Per cui risulta:
LB→C = n · R · T · ln (PB / PC) = 2 · 8,314 · 488 · ln (4 PA / PA) = 11249 J
e
LD→A = n · R · T · ln (PD / PA) = 2 · 8,314 · 122 · ln (0,57 · 105 / 2 · 105) = - 2542 J
Pertanto il lavoro totale svolto durante il ciclo è:
L = LA→B + LB→C + LC→D + LD→A = 11249 - 2542 = 8707 J
In definitiva risulta un calore pari a:
Q = L = + 8707 J
Quindi il gas avrà acquisito calore pari a 8707 J ed avrà compiuto lavoro sull'ambiente esterno pari allo stesso valore di Q.
Studia con noi