Deidroalogenazione degli alogenuri alchilici
Reazione di ß eliminazione: il meccanismo E2
Quando si fa reagire con una base forte un alogenuro alchilico che abbia idrogeni in posizione ß (cioè che abbia un atomo di idrogeno legato ad un atomo di carbonio adiacente a quello che porta l'alogeno) si ottiene una reazione di eliminazione che porta alla formazione di un alchene.
Poiché il protone viene perduto dal carbonio in beta rispetto all'alogeno, la reazione viene detta ß-eliminazione.
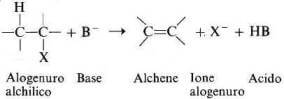
Da questa equazione si può notare che la ß-eliminazione è il processo inverso della addizione di un acido alogenidrico ad un alchene.
La velocità della reazione di ß-eliminazione dipende dalla concentrazione sia dell'alogenuro alchilico che della base; è pertanto una reazione di secondo ordine:
v= k [alogenuro] [base]
Per tale motivo queso tipo di reazione viene identificata con la sigla E2 in cui E sta per eliminazione e 2 sta per secondo ordine. La reazione pertanto avviene in un unico stadio, non vengono prodotti composti intermedi e non si verificano trasposizioni nello scheletro idrocarbonico.
Meccanismo di reazione
Il meccanismo della reazione prevede un unico stadio in cui si ha la rottura concertata dei legami C―H e C―X e la contemporanea formazione del doppio legame carbonio-carbonio.
Osservazioni sperimentali portano anche ad affermare che si verifica una trans-eliminazione; essa viene ottenuta da una sistemazione coplanare sia degli atomi H e X che vengono eliminati, sia dei due atomi di C che formeranno il doppio legame.
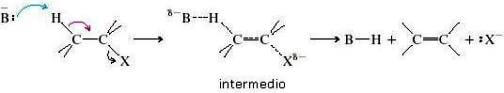
Regioselettività nelle reazioni di ß-eliminazione
Nel caso che la deidroalogenazione di un alogenuro alchilico possa portare alla formazione di diversi isomeri costituzionali, la reazione obbedisce alla regola di Zaitsev e si ottiene l'alchene più altamente sostituito (reazione regioselettiva).
Ad esempio, nella reazione di deidrobromurazione del 2-bromo-2-metilbutano, si forma in maggiori quantità l'isomero 2-metil-2-butene, in quanto più altamente sostituito:
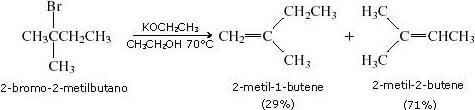
Stereoselettività nelle reazioni di ß-eliminazione
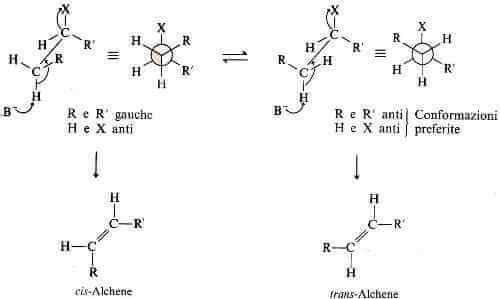
Oltre ad essere regioselettive, le reazioni di ß-eliminazione sono anche stereoselettive. Nel caso in cui si possano formare gli stereoisomeri cis/trans, in genere si forma in maggior quantità l'isomero trans (E).
Se consideriamo ad esempio l'alogenuro RCH2CHR'X possiamo notare che la necessità di una conformazione anti-coplanare e il minor livello di energia che risulta quando R e R' sono anti invece che gauche, operano insieme e possono spiegare perché si ha predominante formazione dell'isomero trans:
Studia con noi