Isotoni
Quando due atomi sono isotoni?
Il nucleo atomico è la zona centrale dell'atomo e in essa sono presenti neutroni e protoni.
I neutroni (solitamente indica con il simbolo n0 o semplicemente n) sono particelle priva di carica elettrica; i protoni (solitamente indicati con il simbolo p+) sono invece particelle con carica elettrica positiva.
Il numero di protoni presenti nel nucleo di un atomo è detto numero atomico (rappresentato con la lettera Z), mentre la somma tra numero di protoni e numero di neutroni è il numero di massa, indicato con la lettera A.
Il numero di massa (A) viene riportato in alto a sinistra del simbolo chimico dell'elemento, mentre il numero atomico (Z) viene posto a sinistra, in basso, del simbolo dell'elemento; considerato che il numero atomico Z è in corrispondenza biunivoca con il simbolo chimico dell'elemento può essere sottinteso e quindi omesso.
Per un generico atomo X avente numero atomico Z e numero di massa A, scriveremo:
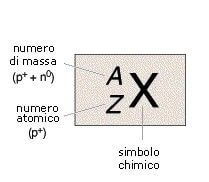
Fatta questa breve ma necessaria introduzione vediamo quando due atomi sono detti isotoni.
Definizione di isotoni
Si dicono isotoni atomi con lo stesso numero di neutroni ma un diverso numero di protoni.
Considerato che il numero di massa A corrisponde alla somma tra il numero di protoni e il numero di neutroni, è possibile definire gli isotoni anche come atomi aventi lo stesso numero di neutroni ma un diverso numero di massa.
Le due definizioni appena date sono equivalenti ed entrambe valide.
Esempi di isotoni
Gli atomi 3He e 2H sono isotoni.
L'atomo 3He è infatti composto da due protoni e un solo neutrone; l'atomo 2H è invece composto da un protone e un neutrone (per info: come trovare il numero di neutroni).
I due atomo in questione hanno lo stesso numero di neutroni (in entrambi i casi è presente un solo neutrone) ma un diverso numero di protoni (2H è composto da un solo protone mentre 3He da due protoni) e quindi sono isotoni.
Allo stesso modo i due atomi hanno lo stesso numero di neutroni ma un diverso numero di massa (3 per l'atomo di elio e 2 per l'atomo di idrogeno).
Sono isotoni anche gli isotopi 13C e 14N.
L'atomo 13C è infatti composto da 6 protoni e 7 neutroni mentre l'atomo 14N è composto da 7 protoni e 7 neutroni: i due atomi presentano lo stesso numero di neutroni ma un diverso numero di protoni e quindi sono isotoni.
Potremmo dire, in base alla seconda definizione data in precedenza, che i due atomi sono isotoni in quanto presentano lo stesso numero di neutroni (7 in entrami i casi) ma un diverso numero di massa (13 per l'atomo di carbonio e 14 per l'atomo di azoto).
Altro esempio di isotoni sono 56Fe e 58Ni; entrambi hanno infatti 30 neutroni.
Atomi isotoni appartengono ad elementi chimici diversi e quindi presentano differenti proprietà chimiche.
Differenza tra isotoni e isotopi
Non bisogna confondere gli isotoni con gli isotopi: questi ultimi sono atomi che presentano lo stesso numero di protoni (e quindi appartengono allo stesso elemento chimico) ma un diverso numero di neutroni o, in alternativa, presentano lo stesso numero atomico Z ma un diverso numero di massa A.
A differenza degli isotoni, gli isotopi appartenendo allo stesso elemento chimico e presentano quindi le stesse proprietà chimiche.
Gli atomi 35Cl e 37Cl sono isotopi in quanto presentano lo stesso numero di protoni (= 17) ma un diverso numero di neutroni: 18 per il primo nuclide e 20 per il secondo nuclide.
Quiz sull'atomo
Se ti interessano li trovi qui: quiz sull'atomo.
Link correlati:
Quando due atomi sono isobari?
Quanti e quali sono gli isotopi dell'ossigeno?
Quanti e quali sono gli isotopi dell'idrogeno?
Studia con noi