Teoria di Bronsted-Lowry
Definizione di acido e base secondo la teoria di Bronsted-Lowry
La teoria di Arrhenius sugli acidi e le basi, anche se di grande importanza per le soluzioni acquose, si rilevò carente quando si volle dare una definizione generalizzata di questi composti.
D'altra parte, tale teoria già considerava scarsamente il fatto che esistono sostanze prive nella loro formula di H+ e OH− e che tuttavia, quando vengono sciolte in acqua, danno reazione acida o basica.
Questa caratteristica fu spiegata pensando che esse dovevano reagire con l'acqua provocando la liberazione di ioni H+ o OH− provenienti da quest'ultima.
Acidi e di basi secondo la teoria di Bronsted e Lowry
Lo scienziato danese J. N. Bronsted e l'inglese T. M. Lowry nel 1923, indipendentemente l'uno dall'altro, proposero una teoria sul comportamento degli acidi e delle basi, che teneva conto del traferimento dei protoni H+.
Essi definirono:
- acido una sostanza capace di cedere ioni H+ (protoni)
- base una sostanza capace di acquistare ioni H+ (protoni)
Secondo la teoria di Bronsted e Lowry, l'acido può donare il protone solo in presenza di una base che lo accetti. Pertanto non esistono acidi e basi come tali, ma solo coppie di acidi e basi che in soluzione acquosa danno luogo a una reazione: la reazione acido-base.
La reazione tra NH3 e H2O è una reazione acido-base in quanto l'acido (acqua) cede un protone alla base (ammoniaca, NH3) formando lo ione ammonio NH4+ e lo ione ossidrile OH−.
![]()
Se, però, prendiamo in considerazione la reazione inversa:
![]()
ne deduciamo che in questo caso è lo ione ammonio NH4+ che si comporta da acido in quanto cede un protone H+ allo ione OH− che si comporta invece da base. Pertanto, la reazione acido-base è una reazione di equilibrio che può essere così rappresentata:
![]()
Il primo membro dell'equazione contiene una specie che si comporta da base (NH3) e una che si comporta da acido (acqua), mentre il secondo membro contiene l'acido e la base che si sono formati e che vengono denominati rispettivamente acido coniugato (NH4+) e base coniugata (OH−).
Pertanto:
NH4+ è l'acido coniugato della base NH3
mentre:
OH− è la base coniugata dell'acido H2O
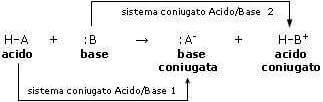
Generalizzando, se si indica con :B una generica base e con HA un generico acido, l'equilibrio della reazione acido-base può essere così schematizzato:
![]()
dove:
BH+ è l'acido coniugato della base :B
mentre:
:A− è la base coniugata dell'acido HA
Link correlati:
Quiz online su acidi e basi
Cosa afferma la teoria di Arrhenius?
Cosa afferma la teoria di Lewis?
Che coso sono pH e pOH?
Studia con noi