Cloruro di magnesio
Proprietà e caratteristiche del cloruro di magnesio
Il cloruro di magnesio è un sale binario con formula chimica MgCl2.
Ha sapore amaro e si presenta come una polvere bianca altamente igroscopica che conferisce queste proprietà al sale da tavola grezzo (cloruro di sodio) che ne contiene sempre piccole quantità.
Oltre al sale anidro sono noti anche alcuni sali idrati con formula generale MgCl2·(H2O)x in cui X assume valori sempre più piccoli all'aumentare della temperatura: X = 12 (a −16,4 °C); X = 8 (a −3,4 °C); X = 6 (a 116,7 °C); X = 4 (a 181 °C); X = 2 (a circa 300 °C).
Come suggerito dall'esistenza dei composti idrati, MgCl2 anidro si comporta da acido di Lewis.
Il cloruro di magnesio è un forte elettrolita e pertanto in acqua è completamente dissociato in ioni:
![]()
Applicazioni del cloruro di magnesio
Il cloruro di magnesio è un intermedio nel processo di produzione del magnesio metallico. Lo ione Mg2+ presente nell'acqua di mare (0,13 % circa) viene precipitato sotto forma di Mg(OH)2 mediante aggiunta di CaO:
MgCl2 + CaO + H2O → Mg(OH)2↓ + CaCl2
L'idrossido di magnesio, separato per filtrazione, e trasformato in CaCl2 con acido cloridrico:
Mg(OH)2 + HCl → MgCl2 + 2 H2O
viene essiccato e dopo essere stato miscelato con cloruro di calcio e cloruro di sodio, viene elettrolizzato per produrre il magnesio metallico.
Il cloruro di magnesio è impiegato nella fabbricazione di cementi refrattari; trova utilizzo anche come regolatore di acidità e agente rassodante.
Non trascurabile è l'utilizzo del cloruro di magnesio come sale da gettere nelle strade ghiacciate.
Segnaliamo infine il fatto che il cloruro di magnesio può essere impiegato come coleretico.
Struttura del cloruro di magnesio
Ioni equivalenti: Mg2+ , Cl− , Cl−
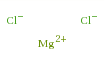
Studia con noi