Potenziale di un elettrodo a idrogeno
Calcolo del potenziale di un elettrodo a idrogeno in condizioni non standard
Calcolare il potenziale dell'elettrodo a idrogeno a un pH = 2,00 e ad una pressione parziale di idrogeno pari a 1200 mmHg.
Svolgimento dell'esercizio
L'esercizio propone il calcolo del potenziale di un elettrodo a idrogeno in condizioni non standard; l'elettrodo si trova infatti immerso in una soluzione a pH = 2,00 e ad una pressione parziale di idrogeno pari a 1200 mmHg.
L'equazione di Nernst è l'equazione che ci permette di calcolare il potenziale di un semielemento che si trova in condizioni non standard. Nel nostro caso specifico, la reazione di riduzione può essere descritta con la seguente equazione chimica:
2 H+ + 2e− → H2
L'equazione di Nernst è la seguente:
![]()
in cui:
- E = potenziale di riduzione in condizioni non standard
- E° = potenziale standard di riduzione, che si misura i volt
- n = numero di elettroni scambiati
- [Red] = concentrazione in mol/L della specie ridotta
- [Ox] = concentrazione in mol/L della specie ossidata
- n e m sono gli eventuali coefficienti stechiometrici della specie ridotta e della specie ossidata
Ricordando che E° (H+/H2) = 0 V, applicata alla precedente semireazione, l'equazione di Nernst assume la seguente forma:
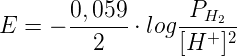
in cui PH2 è la pressione parziale dell'idrogeno espressa in atmosfere; per il calcolo del potenziale di riduzione dell'elettrodo è quindi necessario convertire i mmHg in atmosfere.
Al riguardo bisogna ricordare che 1 atm = 760 mmHg. Impostiamo pertanto la seguente proporzione:
1 : 760 = X : 1200
Da cui:
X = 1,58 atm
Pertanto la pressione parziale dell'idrogeno espressa in atmosfere è PH2 = 1,58 atm.
Rimane da calcolare la concentrazione dello ione H+. Conoscendo il pH è possibile calcolare [H+] mediante la seguente formula:
[H+] = 10-pH
da cui:
[H+] = 10-pH = 10-2 = 0,01 mol/L
Non ci rimane altro che sostituire i valori trovati nell'equazione precedente:
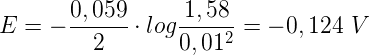
Pertanto il potenziale dell'elettrodo a idrogeno è pari a -0,124 V.
Studia con noi