Saponificazione
Idrolisi base-catalizzata degli esteri
La reazione di un estere con una base forte si chiama saponificazione.
È un processo coinvolto nella preparazione dei saponi (da cui il nome), ed è quindi una delle reazioni chimiche conosciute dai tempi più remoti.
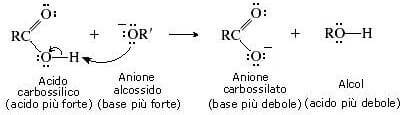
A differenza dell'idrolisi acido-catalizzata, la saponificazione è una reazione irreversibile in quanto lo ione carbossilato, prodotto nella reazione, è incapace di dare una sostituzione nucleofila acilica con l'alcol.
![]()
La saponificazione di un estere segue una cinetica di secondo ordine.
L'espressione dell'equazione di velocità per la saponificazione è infatti:
![]()
da cui risulta che sia l'estere che la base sono coinvolti nello stadio lento della reazione. Due meccanismi differenti sono plausibili per una cinetica di questo tipo: il primo coinvolgente la rottura del legame acilico C-O; il secondo quella del legame alchilico O-C.
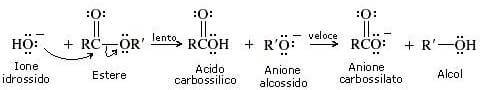
Scissione acilica (scissione del legame C-O)
Viene spezzato il legame tra il gruppo acilico e l'ossigeno.
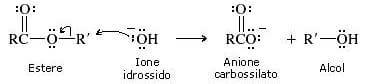
Scissione alchilica (scissione del legame O-C)
Viene spezzato il legame tra il gruppo alchilico e l'ossigeno.
Marcando con 18O l'ossigeno alchilico di un estere, l'atomo marcato si ritrova nell'alcol e non nel sale dell'acido, dimostrando così che si è rotto il legame tra l'ossigeno alchilico e il carbonio carbonilico (scissione acilica):
RCO18OCH3 + OH− → RCOO− + CH318OH
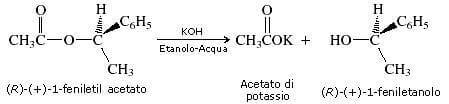
Ad una conclusione identica si può giungere con studi stereochimici. La saponificazione di esteri di alcoli otticamente attivi, come ad esempio la saponificazione del (R)-(+)-1-feniletil acetato, avviene con ritenzione di configurazione.
Ciò è possibile solo ammettendo la rottura del legame C-O e non la rottura del legame O-C (in tal caso infatti si avrebbe inversione di configurazione).
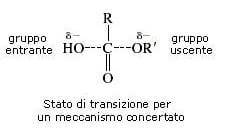
Appurato che la reazione procede attraverso la rottura del legame C-O (scissione acilica), rimane da stabilire se la reazione procede attraverso un meccanismo concertato (sostituzione diretta) o mediante una addizione e successiva eliminazione (ovvero attraverso la formazione di un composto intermedio).
Tramite un meccanismo di sostituzione diretta (meccanismo concertato) la scissione del legame acile-ossigeno e l'attacco del gruppo OH− (gruppo entrante) al carbonio carbonilico avverrebbero contemporaneamente.
Quando l'ossigeno carbonilico di un estere viene marcato con 18O, si verifica uno scambio con l'16O dell'acqua (solvente) , il che costituisce una buona prova a favore del fatto che la reazione non procede per sostituzione diretta.
Infatti, prelevando vari campioni di estere a reazione non ultimata, risulta che parte dell'estere non è più radioattivo, mentre diventa radioattiva l'acqua.
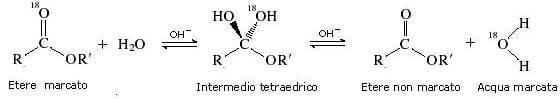
Se la reazione fosse stata una sostituzione diretta al carbonile, non sarebbe stato possibile ritrovare parte dell'estere non più radioattivo (tutto l'estere non ancora idrolizzato doveva essere radioattivo).
Meccanismo della reazione
Nel primo passaggio della reazione si ha l'attacco nucleofilo dell'ossidrile al carbonio carbonilico dell'estere.
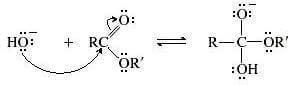
È lo stadio più lento che determina quindi la velocità complessiva di tutta la reazione.
Nel secondo passaggio della reazione il solvente (acqua) cede un protone all'intermedio anionico.
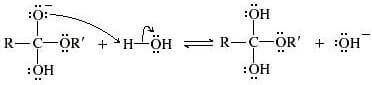
Nel terzo passaggio della reazione l'intermedio tetraedrico si dissocia formando un anione alcossido e un acido carbossilico.
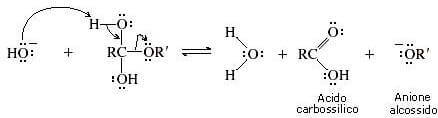
Nel quarto passaggio della reazione (passaggio irreversibile) lo ione alcossido si comporta da base di Bronsted-Lowry e strappa un protone all'acido carbossilico. Si ha la formazione dell'anione carbossilato (prodotto finale della reazione).
Studia con noi