Interazione dipolo - dipolo indotto
Generalità e proprietà delle interazioni dipolo permanente-dipolo indotto
L'interazione dipolo permanente-dipolo indotto (detta anche interazione di Debye) si ha tra molecole polari e molecole non polari.
Per comprendere tale interazione bisogna considerare cosa succede ad una molecola apolare (o a un atomo) quando viene immersa in un campo elettrico.
Nella molecola non polarizzata il baricentro delle cariche positive coincide con il baricentre delle cariche negative.
Quando la molecola viene immersa in un campo elettrico, succede che la nuvola elettronica carica negativamente viene deformata ed attratta dal polo positivo; viceversa il nucleo dell'atomo carico positivamente viene attratto dal polo negativo.
Il campo elettrico esterno pertanto induce una separazione di carica nella molecola e la formazione di un dipolo temporaneo (dipolo indotto).
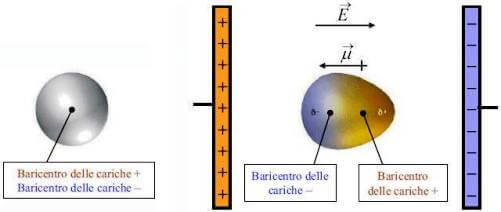
Tanto maggiore è intensità del campo elettrico E applicato tanto maggiore sarà l'intensita del dipolo indotto µ; infatti:
![]()
in cui a è una costante di proporzionalità detta polarizzabilità che misura la facilità con cui la molecola o l'atomo si polarizza quando immersa in un campo elettrico. Ogni atomo o molecola ha un valore caratterstico di a che viene misurato in (C · m2 · V-1).
Quando una molecola polare si avvicina ad una molecola non polare, si ha lo stesso effetto visto in precedenza: la molecola polare induce un dipolo (dipolo indotto) sulla molecola non polare.
Tale dipolo perdura sino a quando le due molecole non si allontanano.
Si genera in questo modo un'attrazione dipolo permanente-dipolo indotto.
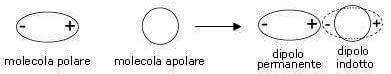
L'intensità della forza attrattiva dipende chiaramente dall'intensità del momento dipolare µ della molecola polare e dalla polarizzabilità della molecola non polare.
Come si calcola l'intensità dell'interazione dipolo permanente-dipolo indotto
L'intensità dell'interazione (interazione di Debye) che si esercita tra una molecola polare di momento µ e una molecola non polare di polarizzabilità a poste ad una distanza r è:
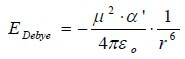
in cui:
µ = momenti di dipolo della molecola polare (C · m)
εo = costante dielettrica del vuoto = 8,854 · 10-12 (C2 · m-2 · N-1)
r = distanza tra le due molecole (m)
α' = volume di polarizzabilità (m3)
Il volume di polarizzabilità è una grandezza che ha le dimensioni di un volume e vale:
![]()
Studia con noi