Ibridazione sp3
Ibridazione sp3 del carbonio
La configurazione elettronica dell'atomo di carbonio allo stato fondamentale è 1s2 2s2 2p2.
Essendovi solo 2 elettroni spaiati e tenendo conto che per la regola di Hund i 2 elettroni p devono occupare 2 degli orbitali degeneri p (degeneri = aventi la stessa energia), il carbonio dovrebbe essere in grado di legare solo 2 atomi di H.
Per spiegare la combinazione del carbonio con 4 atomi di H nella molecola del metano (CH4) si deve ammettere che un elettrone dell'orbitale 2s venga "promosso" all'orbitale 2p vuoto: ciò avviene con assorbimento di una considerevole quantità di energia. In questo modo è possibile ammettere la formazione di quattro legami da parte del carbonio.
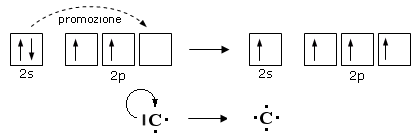
Però, siccome l'orbitale atomico 2s sferico ha energia inferiore e forma diversa da quella dei tre orbitali 2p (2px, 2py, 2pz), dovremmo aspettarci tre legami uguali ed uno diverso; l'equivalenza degli atomi di H nella molecola del metano (CH4) richiede invece che i 4 legami siano uguali e quindi che siano uguali i 4 orbitali impegnati in questi legami.
Secondo L. Pauling ciò può essere spiegato ammettendo una fusione e ridistribuzione di cariche chiamata ibridazione.
La teoria suggerisce il "mescolamento" dell'orbitale 2s con i tre orbitali 2p: tale mescolamento è matematico, delle funzioni d'onda dell'orbitale, e quindi non è un reale fenomeno fisico.
Ibridando l'orbitale s con 3 orbitali p si ottengono 4 orbitali ibridi identici tra loro: i nuovi 4 orbitali ibridi, chiamati sp3, hanno per ¼ le caratteristiche dell'orbitale s di partenza e per ¾ le caratteristiche degli orbitali 2p.
Nella dicitura sp3 il 3 esponente di p indica il numero di orbitali p che partecipano alla formazione dell'ibrido. La forma di ciascun orbitale ibrido sp3 è la seguente:

Forma dell'orbitale sp3.
Il lobo di dimensione maggiore è quello che viene utilizzato nei legami. Talvolta, per questioni di praticità, non si rappresenta il lobo di dimensione minore.
Orientazione degli orbitali ibridi sp3
I quattro orbitali ibridi sp3 sono diversamente orientati nello spazio: puntano verso i vertici di un tetraedro; gli assi di questi orbitali sono pertanto equidistanti e formano tra loro angoli di 109,5°.
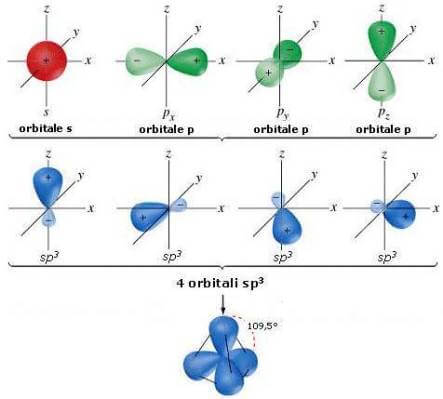
I quattro orbitali ibridi sp3.
La disposizione degli orbitali ora descritta si può avere solo se gli orbitali stessi si ricoprono con orbitali di altri atomi dando luogo a orbitali molecolari orientati lungo gli assi che congiungono i nuclei dei due atomi interessati.
Ad esempio, nella formazione della molecola del metano, si ha una sovrapposizione tra i 4 orbitali ibridi sp3 dell'atomo di carbonio e i 4 orbitali 1s (di forma sferica) appartenenti ai 4 atomi di idrogeno:
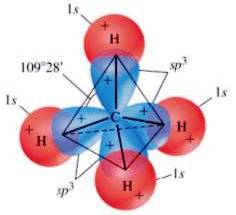
Orbitali molecolari nella molecola del metano.
Tale disposizione degli orbitali molecolari è spiegata anche dalla teoria VSEPR: secondo tale teoria, le coppie di elettroni più esterne, avendo tutte la stessa carica negativa, tendono a respingersi le une con le altre e a disporsi il più lontano possibile.
La disposizione che permette alle quattro coppie di elettroni (una coppia per ciascun legame covalente) coinvolte nella formazione dei quattro legami molecolari, di disporsi il più lontano possibile, è quella descritta poc'anzi.
Link correlati:
Ibridazione dell'atomo di azoto
Studia con noi