Miosina
Che cos'è la miosina?
Il termine “miosina” indica un gruppo di macromolecole organiche molto numeroso riunito in classi distinte e coinvolte in differenti processi fisiologici, principalmente legati al funzionamento dell'apparato muscolo scheletrico.
La classe più rappresentativa di queste molecole è la classe delle Miosine II, che svolgono un ruolo determinante nella contrazione muscolare, agendo in accoppiamento con i filamenti di actina in presenza di ATP. Tra le altre classi di miosina esistenti (solo nel genoma umano ve ne sono 39) anche le classi I, V e VI partecipano alla contrazione muscolare.
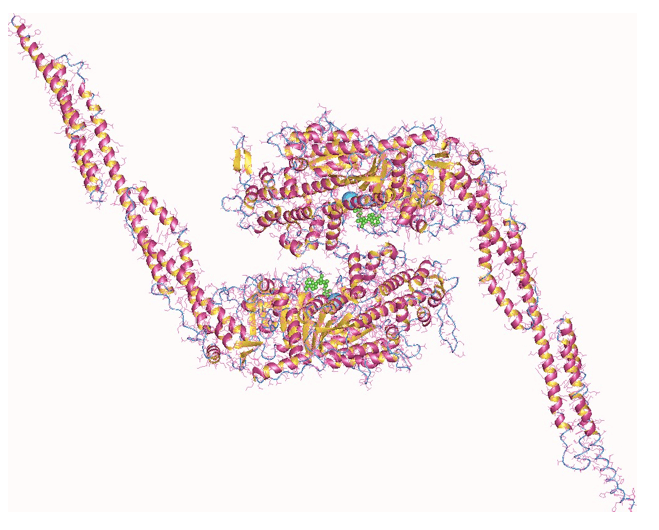
Figura 1: La miosina II, molecola fondamentale per la contrazione della muscolatura striata.
Miosina 2: Composizione generale
La miosina II è il principale motore della contrazione muscolare nella muscolatura striata; è pertanto una molecola fondamentale per consentire il movimento negli organismi animali.
La struttura della macromolecola è data dall'interazione di diverse catene peptidiche codificate da geni differenti, la cui regolazione pare essere mediata da fattori legati all'allenamento. La struttura finale della molecola, infatti, può configurarsi in differenti isoforme, e i processi fisiologici legati all'attività motoria ne dirigono i processi verso l'una o l'altra forma.
La composizione generale della miosina II è data dalla presenza di due catene pesanti (circa 200 Da), costituite da una testa di forma globulare ed una coda di natura fibrosa, e quattro catene leggere connesse a quelle pesanti mediante legami che si realizzano nella zona di transizione tra la testa e la coda, detta "collo", e avvolte intorno alla parte iniziale della loro porzione fibrosa (coda).
Ogni catena pesante interagisce con due catene leggere, una definita essenziale e l'altra regolatrice, che sono in grado di legare ioni Calcio (Ca2+).
Struttura e siti attivi delle catene pesanti della miosina
Le catene pesanti della miosina II sono state analizzate mediante la scomposizione delle catene in componenti più piccole ad opera di specifici enzimi proteolitici in grado di attaccare la molecola in punti particolari.
Questi punti di attacco delle proteasi rappresentano le porzioni flessibili della molecola ("cerniere") che le conferiscono le proprietà necessarie a mediare i meccanismi di contrazione muscolare. La proteolisi specifica delle catene pesanti della miosina rivela una composizione formata da due porzioni di differente dimensione: una meromiosina leggera ed una meromiosina pesante.
La meromiosina pesante può essere a sua volta scomposta in due domini S1, di natura globulare, che vanno a formare la parte della testa, ed un dominio S2 di forma bastoncellare che rappresenta la coda. Nei domini S1 sono presenti i siti di legame per l'actina e il dominio attivo per il legame e l'idrolisi dell'ATP necessaria al funzionamento di questo motore biologico, posizionati in una regione definita "dominio motore"; il collo è la sede della giunzione con le catene leggere che si avvolgono attorno alla prima parte della coda.
Organizzazione dei miofilamenti e dei sarcomeri
Le molecole di miosina si organizzano insieme a formare filamenti spessi, detti miofilamenti, organizzati in maniera polare. Le teste globulari si dispongono alle due estremità del filamento spesso, lasciando all'interno le porzioni fibrose delle code.
I filamenti spessi di miosina si uniscono ai filamenti sottili formati dall'altra molecola coinvolta nella contrazione muscolare, l'actina, andando a formare le miofibrille la cui unità strutturale è, per l'appunto, il sarcomero. Ogni sarcomero ospita 6 fascetti di miosina. Le miofibrille, infine, sono riunite in gruppi che formano le fibre muscolari.
All'interno dei sarcomeri, i filamenti spessi di miosina e quelli sottili di actina scorrono gli uni sugli altri permettendo la contrazione del muscolo scheletrico.
La struttura del sarcomero appare come una alternanza di bande delimitata alle estremità da due strie dette linee Z, che costituiscono l'attacco per i filamenti di actina i quali occupano la parte più esterna del sarcomero, collocati in bande chiare dove la miosina è assente. All'interno del sarcomero, le bande chiare più interne sono composte solo da miosina, che nella zona centrale del sarcomero (zona M) sono connesse a proteine citoscheletriche.
Nelle cosiddette bande A, più scure e poste a metà strada tra le linee Z e la zona M, si ritrovano invece sia la miosina che l'actina, disposte in maniera alternata, rappresentando pertanto la sede dell'interazione tra di esse.
In definitiva, quindi, actina e miosina occupano rispettivamente la porzione esterna ed interna del sarcomero, connettendosi alle proteine che costituiscono la linea Z o la zona M e venendo in contatto solo nella porzione intermedia tra queste due zone, dove i due tipi di filamenti si protraggono per poter interagire tra loro.
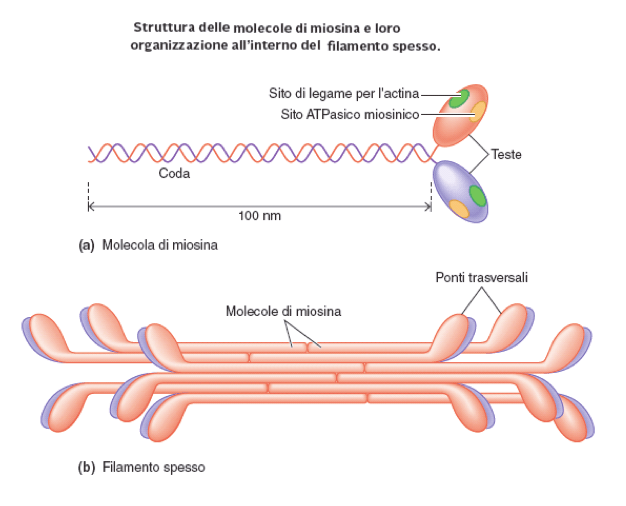
Figura 2: Struttura e organizzazione della miosina.
Funzionamento della miosina II
La miosina II è la principale responsabile della contrazione muscolare in accoppiamento con i filamenti di actina, realizzando un motore biologico che sfrutta l'energia liberata dall'idrolisi dell'ATP.
In condizioni di assenza dell'ATP, la molecola di miosina si trova in uno stato conformazionale di riposo definito "rigor"; nel momento in cui l'ATP entra in contatto con il proprio sito attivo si determina una prima modificazione della struttura della molecola, con il distacco della testa dal filamento e l'avvicinamento di questa alla molecola di actina.
L'idrolisi dell'ATP determina il secondo cambio della conformazione, con la flessione della testa e la sua distensione verso l'estremità + del filamento di actina, che permette il contatto ed il legame del sito motore di S1 con la molecola di actina.
A questo punto si determina il cosiddetto "colpo di forza", che spinge il filamento sottile di actina verso la parte centrale del sarcomero, in corrispondenza alla liberazione del gruppo fosfato dall'ATP, che diviene così ADP. Il colpo di forza si genera mediante una torsione della coda rispetto al collo consentita dall'energia rilasciata.
Infine, con l'espulsione dell'ADP dal sito attivo presente nel dominio S1, si determina il ritorno allo stato conformazionale iniziale di rigor.
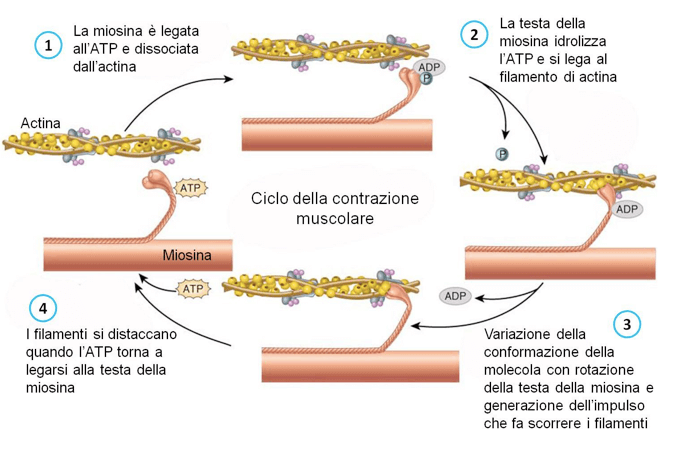
Figura 3: Fasi dell'interazione ATP-dipendente della miosina con l'actina.
Link correlati:
Proprietà e caratteristiche delle fenilendiammine
Studia con noi