pH di una soluzione di acido solfidrico
Calcolo del pH di una soluzione di acido solfidrico
Si calcoli il pH di una soluzione 0,1 M di acido solfidrico (H2S). Si sappia che Ka1 = 1,1 · 10-7 e che Ka2 = 1,1 · 10-14.
Svolgimento dell'esercizio
L'esercizio propone il calcolo del pH di una soluzione di acido solfidrico la cui formula chimica è H2S. L'acido solfidrico è un acido diprotico le cui dissociazioni sono entrambe deboli (infatti si ha che Ka1 = 1,1 · 10-7 e Ka2 = 1,1 · 10-14).
L'acido solfidrico è un acido diprotico che si ionizza nel seguente modo:
H2S + H2O ⇆ H3O+ + HS−
HS− + H2O ⇆ H3O+ + S2−
Calcoliamo inizialmente la concentrazione degli ioni H+ derivanti dalla prima ionizzazione:
H2S + H2O ⇆ H3O+ + HS−
Per eseguire questo calcolo consideriamo H2S come se fosse un acido debole monoprotico (al riguardo si veda: pH di un acido debole monoprotico) e applichiamo la formula semplificata per il calcolo della [H3O+]:
![]()
e che quindi siccome [HS−] = [H3O+] si ha che [HS−] = 1,05 · 10-4.
Determiniamo ora la concentrazione degli ioni H+ derivanti dalla seconda ionizzazione:
HS− + H2O ⇆ H3O+ + S2−
Si ha che:
..........HS− + ....H2O ⇆ .....H3O+ + .......S2−
inizio...1,05·10-4.............1,05·10-4.......0
fine...1,05·10-4-Y............1,05·10-4+Y......Y
Ricordando che:
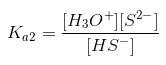
si ha che:
Ka2 = (1,05·10-4 + Y) · Y / (1,05·10-4 - Y)
Si ottiene una equazione di secondo grado che deve essere risolta:
Ka2 = (1,05·10-4 · Y + Y2) / (1,05·10-4 - Y)
1,1 · 10-14 = (1,05·10-4 · Y + Y2) / (1,05·10-4 - Y)
Da cui:
1,1 · 10-14 · (1,05 · 10-4 - Y) = 1,05 · 10-4 · Y + Y2
1,155 · 10-18 - 1,1 · 10-14 · Y = 1,05 · 10-4 · Y + Y2
Y2 + 1,05 · 10-4 · Y + 1,1 · 10-14 · Y - 1,155 · 10-18 = 0
Y2 + 1,05 · 10-4 · Y - 1,155 · 10-18 = 0
Da cui risolvendo l'equazione di secondo grado:
Y ≃ 1,1 ∙ 10-14
Ovvero:
[H+] = 1,1 ∙ 10-14
La [H+] totale è la somma dei due contribuiti (della prima ionizzazione e della seconda ionizzazione), per cui si ha che:
[H+] = 1,05 · 10-4 + 1,1 ∙ 10-14 ≃ 1,05 · 10-4
per cui:
pH = - log [H+] = - log (1,05 · 10-4) = 3,98
Come si può notare, in questo caso, dove Ka2 << Ka1, pertanto la [H3O+] è dovuta unicamente alla prima dissociazione. È necessario tenere conto della seconda ionizzazione solo se si vuole determinare la concentrazione di S2−. Le concentrazioni sia di HS– che di H3O+ non sono influenzate dalla seconda reazione di equilibrio.
Per un acido diprotico debole in entrambe le dissociazioni, in tutti i casi in cui Ka2 << Ka1, per il calcolo della [H3O+] è sufficiente quindi tenere conto unicamente della prima ionizzazione. Si può considerare Ka2 << Ka1 quando la Ka2 è più piccola di un fattore 100 rispetto alla Ka1.
Link correlati:
Esercizi online e gratuiti sul pH e sul pOH
Studia con noi