Geometria di ioni poliatomici
Esercizo: geometria di ioni poliatomici
Esercizio #1
In base alla teoria VSEPR prevedere la geometria dei seguenti ioni:
a) BH4−
b) NH4+
c) CCl3−
Se non è chiara la teoria VSEPR vi rimandiamo alla seguente dispensa: come prevedere la geometria di una molecola tramite la teoria VSEPR e alla seguente dispensa: geometria delle molecole.
Passiamo ora alla svolgimento dell'esercizio
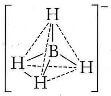
a) BH4−
Disegnata la struttura a puntini di Lewis (per approfondimenti: esercizi sulla struttura a puntini di Lewis), ci si rende conto che la molecola può essere rappresentata con la formula generica AX4E0 in cui con A viene indicato l'atomo centrale (B), con X il numero di atomi legati all'atomo centrale (sono quattro) e con E le coppie di elettroni solitarie presenti sull' atomo centrale (in questo caso non sono presenti coppie di elettroni sull'atomo centrale).
Quindi NS = 4. La geometria è pertanto tetraedrica.
b) NH4+
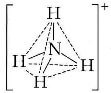
Anche in questo caso (ione ammonio) la molecola può essere rappresentata con la formula generica AX4E0 in cui con A viene indicato l'atomo centrale (N), con X il numero di atomi legati all'atomo centrale (sono quattro) e con E le coppie di elettroni solitarie presenti sull' atomo centrale (anche in questo caso non sono presenti coppie di elettroni sull'atomo centrale).
Quindi NS = 4. La geometria è pertanto tetraedrica.
c) CCl3−
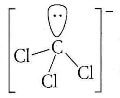
Disegnata la struttura a puntini di Lewis, ci si rende conto che la molecola può essere rappresentata con la formula generica AX3E1 in cui con A viene indicato l'atomo centrale (C), con X il numero di atomi legati all'atomo centrale (sono tre) e con E le coppie di elettroni solitarie presenti sull' atomo centrale (una coppia di elettroni).
Quindi NS = 4. La geometria è pertanto piramidale trigonale.
Studia con noi