Stabilità degli alcheni
Stabilità e calore di idrogenazione degli alcheni
Un metodo per definire la stabilità relativa degli alcheni è quello di determinare il calore di idrogenazione.
Il calore di idrogenazione (∆HH) corrisponde alla variazione di entalpia che si ha quando una molecola di alchene viene idrogenata ad alcano:
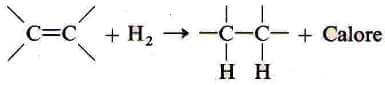
La reazione di idrogenazione è sempre esotermica e il calore di idrogenazione è sempre un numero negativo.
Se un alchene è meno stabile di un suo isomero insaturo, significa che la sua energia interna è maggiore rispetto a quella dell'isomero insaturo (più alto è il contenuto di energia, più instabile è il composto); dalla reazione di idrogenazione dell'alchene meno stabile si svolgerà più calore e quindi il calore di idrogenazione dell'alchene meno stabile avrà un valore negativo maggiore.
Per poter rendere più chiaro questo concetto, consideriamo come esempio l'idrogenazione dei due buteni isomeri:
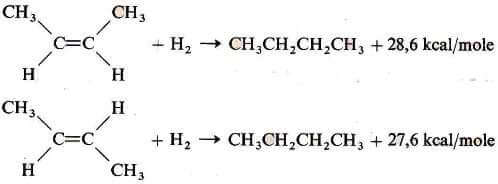
Come è possibile notare dalla figura seguente, il composto cis-2-butene è meno stabile (e quindi ha un contenuto di energia maggiore) del composto trans-2-butene e quindi nella reazione di idrogenazione sviluppa circa 1 Kcal/mole in più dell'isomero trans (per ulteriori info si veda: 2-butene).
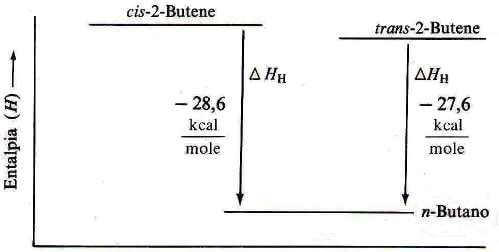
Contenuto relativo di energia del cis- e del trans-2-butene
Pertanto, la differenza tra i calori di idrogenazione degli alcheni isomeri è una misura quantitativa della loro stabilità.
Da questi dati è possibile concludere che gli alcheni aciclici trans sono di norma più stabili dei corrispondenti isomeri cis di una quantità che è in relazione con la natura dei sostituenti legati al doppio legame C=C.
Queste differenza di stabilità possono essere facilmente interpretate osservando la figura seguente:

Tensioni steriche negli alcheni cis e trans
Nell'isomero cis i due sostituenti voluminosi legati ai due atomi di C del doppio legame, interferiscono tra loro, provocando una compressione sterica nella molecola; tanto più grandi sono i sostituenti, tanto più forti sono le tensioni steriche.
Negli isomeri trans i due sostituenti si trovano lontano l'uno dall'altro e pertanto le interazioni steriche sono notevolmente inferiori.
Ordine di stabilità degli alcheni
Dai valori dei calori di idrogenazione è possibile definire l'ordine di stabilità degli alcheni (non impediti):
R2C=CR2 > R2C=CHR > R2C=CH2 ˜ trans-RCH=CHR > cis-RCH=CHR > RCH=CH2 > CH2=CH2
I risultati indicano che gli alcheni più altamente sostituiti con gruppi alchilici sono i più stabili.
Una spiegazione di questo andamento può essere data considerando l'effetto induttivo dei gruppi alchilici; infatti un grupo alchilico legato al doppio legame C=C è più efficiente nel soddisfare le caratteristiche elettron-attrattrici del carbonio ibridato sp2. In misura molto minore a definire l'ordine di stabilità degli alcheni interviene anche l'effetto chiamato iperconiugazione.
Studia con noi