Regola di Markovnikov
Addizione di acidi protici ad alcheni asimmetrici
La regola di Makovnikov stabilisce che, nel caso di addizioni di acidi protici H―Z ad alcheni asimmmetrici, l'idrogeno dell'acido si addiziona all'atomo di carbonio del doppio legame che ha il maggior numero di atomi di idrogeno legati a sé , mentre l'alogeno si addiziona al carbonio meno idrogenato.
La regola di Markovnikov è valida per esempio nel caso di addizioni di acidi alogenidrici (H―Cl, H―Br, H―I), di addizione dell'acido solforico (H―OSO3H), dell'acido trifluoro acetico (CF3COO―H) e di acidi più deboli (esempio: acqua, H―OH o acido acetico, CH3COO―H) che necessitano della presenza di una traccia di acido forte come catalizzatore.
La regola di Markovnikov prevede correttamente l'orientazione degli esempi seguenti:
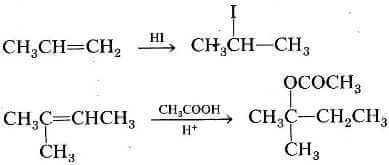
Spiegazione della regola di Markovnikov
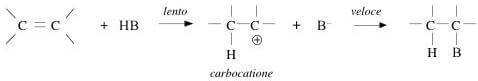
Per capire la base su cui poggia questa regola è necessario conoscere il meccanismo delle reazioni di addizione al doppio legame. Tali reazioni svolgono attraverso un processo polare a due stadi.
Il primo stadio è quello che determina la velocità della reazione e coinvolge l'attacco del protone dell'acido al legame π dell'alchene con formazione di un carbocatione.
Nello stadio successivo lo ione carbonio carico positivamente reagisce rapidamente con i nucleofili presenti.
Consideriamo l'addizione di alcol cloridrico all'isobutilene. Si possono formare due differenti carbocationi, a seconda che il protone si addizioni all'uno o all'altro carbonio del doppio legame.
La susseguente addizione di Cl− al carbocatione porta nei due casi al cloruro di t-butile e al cloruro di isobutile, ma in realtà si osserva solamente la formazione del cloruro di t-butile.
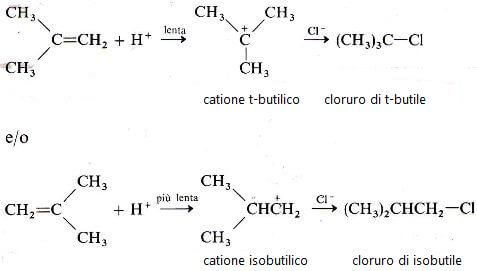
Abbiamo due possibilità per spiegare tale risultato. Può essere che il cloruro di t-butile sia il più stabile dei due cloruri e che la reazione sia sotto controllo termodinamico, oppure può essere che il cloruro di t-butile si formi in maniera più veloce, sotto controllo cinetico.
Dato che la reazione nelle condizioni sperimentali non è facilmente reversibile si può ritenere che non sia operante un controllo termodinamico.
Quindi la reazione deve essere sotto controllo cinetico e il cloruro alchilico che si forma più velocemente deve essere quello che si ottiene dal carbocatione che si forma più velocemente, dato che la formazione del carbocatione è lo stadio determinante la velocità globale di reazione.
Quando addizioniamo un protone all'isobutilene possiamo prevedere che esso si addizioni rapidamente al carbonio più esterno, in modo tale che venga generato un carbonio terziario t-butilico, che non nell'altro carbonio, caso in cui si ottiene un catione isobutilico meno stabile (catione primario).
Non stiamo dicendo che il carbocatione terziario si forma più velocemente del primario perché è più stabile di quest'ultimo ma diciamo che si può prevedere che lo stadio di transizione che porta alla formazione del carbocatione terziario sia di energia più bassa di quello che porta alla formazione del carbocatione primario, dato che gli stati di transizione in questo caso sono simili ai cationi come strutture e ne riflettono le relative stabilità.
Studia con noi