Isomeria conformazionale
Definizione di isomeria conformazionale
Gli isomeri conformazionali differiscono a seguito di una libera rotazione attorno al legame semplice carbonio-carbonio.
In conseguenza di questa rotazione, sono possibili un numero infinito di strutture chiamate conformeri o rotameri.
Nella figura seguente viene rappresentata la libera rotazione intorno al legame C-C nella molecola dell'etano.
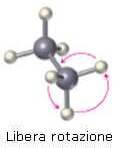
Nella molecola dell'etano è possibile immaginare due casi limite di sistemazione di un gruppo metilico rispetto all'altro gruppo metilico.
Queste due conformazioni vengono indicate con il nome di conformazione eclissata e conformazione sfalsata:
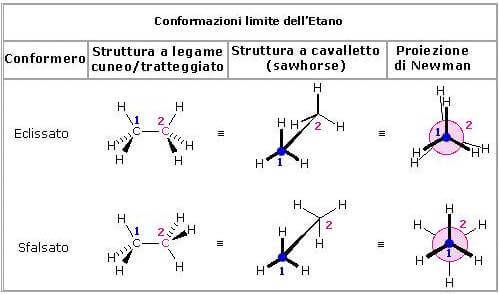
Nelle proiezioni di Newman della conformazione eclissata, l'angolo compreso tra il legame C-H del carbonio anteriore e quello del carbonio posteriore corrisponde a 0° e quindi gli idrogeni del carbonio posteriore e gli idrogeni del carbonio anteriore sono perfettamente allineati. Nella conformazione sfalsata tale angolo corrisponde ad un valore di 60°.
Per una questione di ingombro sterico e a causa della repulsione delle nuvole elettroniche dei legami C-H, la conformazione sfalsata è più stabile della conformazione eclissata (infatti nella conformazione eclissata gli atomi di idrogeno appartenenti ai due atomi di carbonio sono più vicini) e quindi la conformazione sfalsata rappresenta un minimo di energia.
L'energia della molecola dell'etano varia pertanto in funzione dell'angolo di rotazione in una maniera approssimativamente sinusoidale:
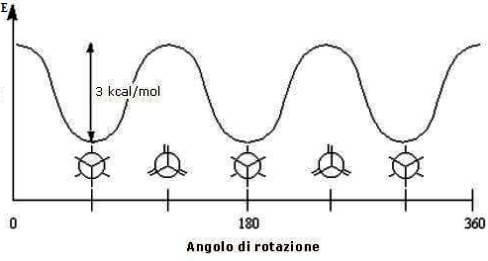
Energia rotazionale o torsionale dell'etano
A temperatura ambiente, l'etano possiede sufficiente energia per superare tale barriera ed essere quindi in rotazione continua: è per questo motivo che gli isomeri conformazionali non sono separabili.
Analisi conformazionale del butano
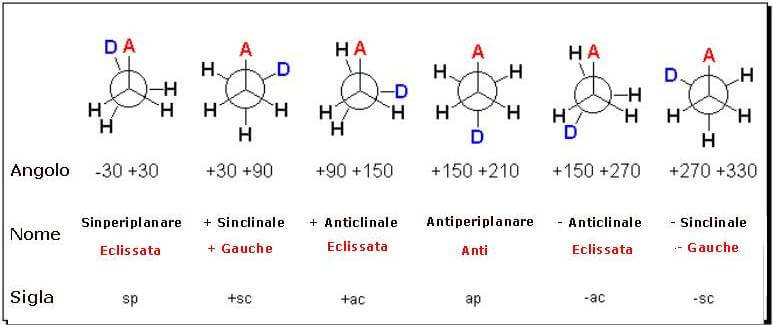
Nel caso del butano, le conformazioni possibili sono più numerose:
Analisi conformazionale del butano
Le forme limite sono quattro:
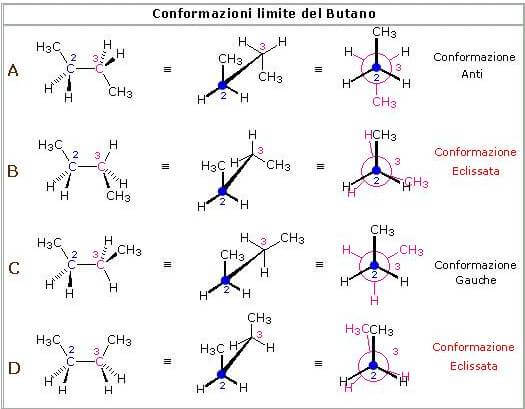
Forme limite del butano
Le strutture eclissate rappresentano sempre massimi di energia:
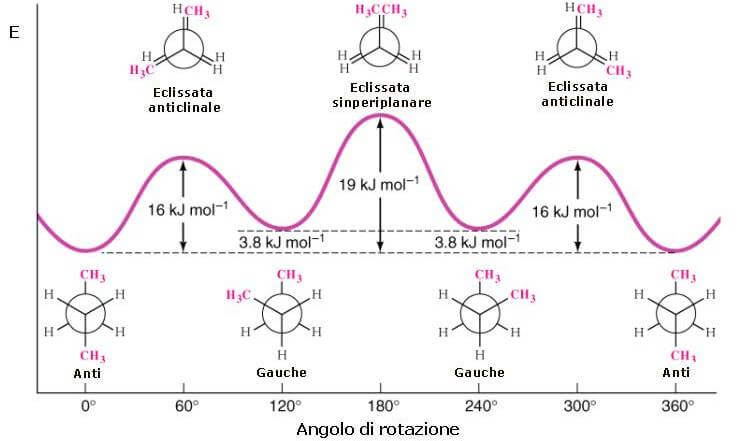
Energia rotazionale del butano
Viene infine studiata l'analisi conformazionale del cicloesano alla quale vi rimandiamo per ulteriori chiarimenti.
Riassumendo
Gli atomi di carbonio sono generalmente liberi di ruotare attorno a un legame singolo e i loro sostituenti possono assumere varie disposizioni nello spazio o conformazioni.
Tra le varie conformazioni possibili per il butano le due estreme sono la completamente eclissata in cui i due CH3 si "eclissano" e la anti (ruotata di 180°).
Per indicare la conformazione anziché le formule prospettiche può essere conveniente usare le proiezioni di Newman ottenute proiettando sul piano del foglio la molecola orientata con il legame a perpendicolare al piano del foglio.
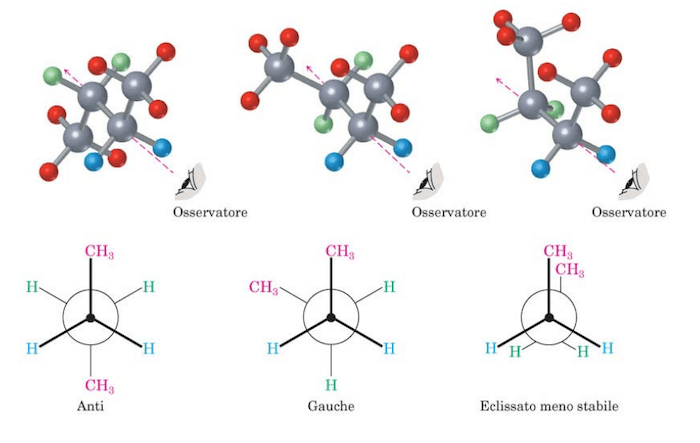
I legami uscenti dal centro si riferiscono al C che sta sopra il piano del foglio, quelli uscenti dal cerchio si riferiscono al C che sta dietro.
Per rotazione attorno al legame la molecola può assumere varie altre conformazioni; la barriera di energia esistente tra queste è tanto bassa (dell'ordine di qualche kcal/mol) che solitamente può avvenire liberamente anche a temperatura ordinaria e pertanto è impossibile isolare gli isomeri conformazionali.
Studia con noi