Cicloesano
Analisi conformazionale del cicloesano
Il cicloesano è un cicloalcano che può essere rappresentato come un esano in cui la catena si chiude su se stessa, perdendo due atomi di idrogeno alle due estremità e unendo direttamente i due atomi di carbonio terminali.
Anche se nella rappresentazione qui data il cicloesano sembra planare, in realtà gli atomi di carbonio non sono legati tutti nello stesso piano.
Infatti, se lo fossero, gli atomi di legame C―C―C dovrebbero essere di 120° invece l'angolo C―C―C preferisce essere il più vicino possibile all'angolo tetraedrico e il forzarlo a 120° richiede dell'energia.
Per questo motivo il cicloesano nel suo stato fondamentale (cioè nel più basso stato di energia) ha una molecola ondulata (conformazione a sedia).
Conformazione a sedia del cicloesano
Il conformero a sedia è il più stabile fra tutti. È una struttura priva di tensioni torsionali e in essa gli idrogeni possono essere divisi in due categorie: idrogeni assiali ed idrogeni equatoriali.
I C-H assiali (nella figura di sinistra colorati in viola) sono paralleli tra loro e sono paralleli anche all'asse di simmetria della molecola. La proiezione di Newman evidenzia la disposizione sfalsata di tutti i legami C-H:
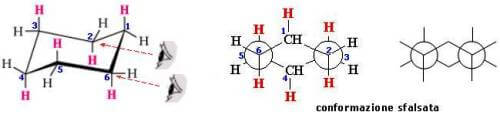
Per quanto riguarda gli idrogeni assiali, se noi procediamo lungo l'anello troviamo alternativamente un idrogeno assiale che punta verso l'alto, il successivo che punta verso il basso, l'altro ancora che punta verso l'alto e così via.
Gli idrogeni equatoriali si trovano tutti sul piano generale della molecola e, alternativamente, puntano anch'essi verso l'alto e verso il basso.
Se l'idrogeno assiale punta verso l'alto, l'idrogeno equatoriale dello stesso atomo di carbonio punta verso il basso e viceversa.
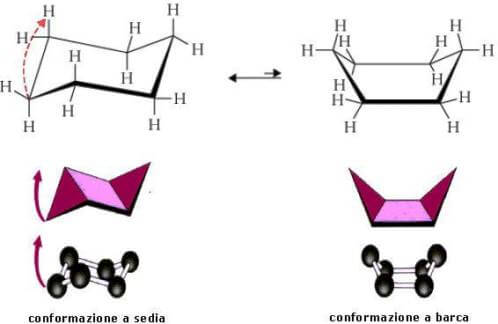
Conformazione a barca
Esiste anche un'altra conformazione possibile per il cicloesano, che mantiene i normali angoli di legame e che viene chiamata struttura a barca; si tratta però di una struttura energeticamente sfavorita.
La conformazione a barca è in rapido equilibrio con la conformazione a sedia e si ottiene da quest'ultima flettendo una delle sue estremità:
È naturalmente possibile ribaltare di nuovo lo stesso atomo di carbonio e tornare alla struttura iniziale.
Ma è possibile anche rovesciare l'altro carbonio all'estremità destra della molecola e passare così all'altra forma a sedia.
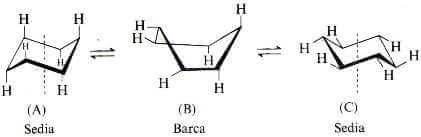
Queste due struttura (A) e (C) sono indistinguibili ma è necessario sottolineare il fatto che nel passare dalla struttura (A) a quella (C) gli idrogeni assiali della formula a sinistra sono diventati equatoriali in quella a destra (e quelli equatoriali sono diventati assiali).
La barriera di energia che separa le due forme a sedia (A) e (C) interconvertibili fra loro è circa 10 Kcal/mole. Una barriera di questo tipo è abbastanza bassa perché le molecole la possano oltrepassare parecchie volte al secondo anche a temperatura ambiente, e questa è la regione per cui non è possibile separare i due conformeri del cicloesano.
Nel passaggio dalla forma a sedia alla forma a barca, il cicloesano assume una struttura avente un massimo di energia nota come struttura a semisedia.
Forma intrecciata
Mentre la forma a sedia è molto rigida, quella a barca può flettersi in quelle che sono chiamate forme intrecciate (twisted o stretched) senza alcuna deformazione degli angoli di legame (si veda figura precedente).
L'energetica dell'interconversione delle due forme a sedia del cicloesano attraverso la forma flessibile può essere riassunta in modo adeguato con l'aiuto di un diagramma della coordinata di reazione mostrato di seguito:
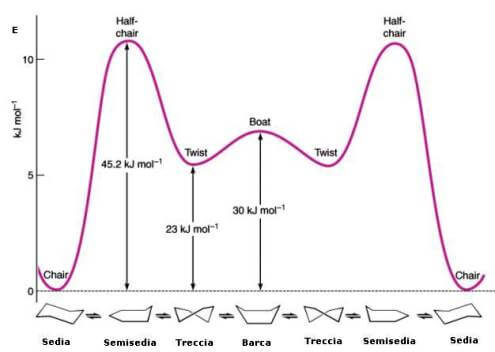
Diagramma della coordinata di reazione per i conformeri del cicloesano
Alcuni feromoni hanno la molecola del cicloesano come struttura base.
Analisi conformazionale: riassunto
Il cicloesano può assumere due conformazioni limite dette a barca e a sedia delle quali la seconda è la più stabile avendo gli atomi di idrogeno perfettamente sfalsati. Nella conformazione a barca vi sono 2 coppie di atomi di C eclissati.
La barriera di energia esistente tra queste due forme è superiore a quella esistente tra gli isomeri conformazionali degli alcani, ma tale energia non è tanto elevata da non permettere la rapida interconversione anche a temperatura ambiente, per cui non è possibile in alcun modo isolare i due isomeri.
Studia con noi