Compressione ed espansione adiabatica
Che cosa sono la compressione e l'espansione adiabatica?
Le trasformazioni adiabatiche sono quelle trasformazioni relative ai gas perfetti che avvengono senza scambi di calore per cui la quantità di calore scambiata risulta nulla ed il primo principio della termodinamica che nella sua forma generale è espresso come:
ΔU = Q - L
si modifica in:
ΔU = -L
Ovvero il lavoro scambiato dal gas con l'ambiente è esterno è pari in valore assoluto alla variazione di energia interna del gas stesso.
Grafico nel piano p-v
Relativamente ad una trasformazione adiabatica, il piano di Clapeyron riporta come grafico una curva rappresentata da un ramo di iperbole, che risulta però più inclinata rispetto al grafico di una trasformazione isoterma, anch'essa caratterizzata nel piano PV da un ramo di iperbole.
Si tratta infatti di un'iperbole non equilatera, ovvero un'iperbole più inclinata rispetto a quelle equilatere che rappresentano le isoterme.
Variazione di temperatura e lavoro
Ricordiamo innanzitutto che le convenzioni dei segni circa il lavoro scambiato da un gas perfetto con l'ambiente sono le seguenti:
- se il gas si espande allora sta eseguendo lavoro sull'ambiente esterno, tale lavoro è positivo L > 0
- se il gas si comprime alla sta subendo lavoro dall'ambiente esterno, tale lavoro è negativo L < 0
Nella compressione adiabatica dunque essendo il lavoro negativo avremo che la variazione di energia interna del gas sarà positiva:
ΔU = -L ed essendo L già negativa risulterà ΔU >0.
L'energia interna è una funzione di stato ovvero dipende soltanto dalla temperatura a cui si trova il gas.
Una variazione di energia interna positiva significa dunque che il gas ha aumentato la propria temperatura. Concludiamo così che nelle compressioni adiabatiche la temperatura del sistema deve aumentare.
Nell'espansione adiabatica invece essendo il lavoro positivo avremo che la variazione di energia interna del gas risulterà negativa:
ΔU = -L ed essendo L già positivo risulterà ΔU < 0.
Una variazione di energia interna negativa in questo caso significa dunque che il gas ha diminuito la propria temperatura. Concludiamo così che nelle espansioni adiabatiche la temperatura del sistema deve diminuire.
Ricapitolando:
- un'espansione adiabatica rappresenta un processo di raffreddamento;
- una compressione adiabatica rappresenta un processo di riscaldamento.
L'equazione di Poisson
L'equazione associata ad una trasformazione adiabatica è l'equazione di Poisson:
P ∙ Vγ = cost
in cui P è la pressione, V il volume del gas e γ (gamma) è il rapporto fra il calore specifico a pressione costante del gas e quello a volume costante.
Tenendo presente l'equazione di stato dei gas perfetti, è possibile esprimere l'equazione di Poisson anche come:
T ∙ Vγ-1 = cost
T ∙ P1-γ/γ = cost
Il γ che compare nella formula è il rapporto fra il calore specifico a pressione costante del gas e quello a volume costante:
γ = Cp / Cv
Questo rapporto per i gas a molecola biatomica (O2, N2, H2 e con buona approssimazione, anche per l'aria) assume il valore di 7/5, mentre per i gas monoatomici vale 5/3.

Primo principio della termodinamica per le trasformazioni adiabatiche
Il primo principio della termodinamica nella sua forma generale:
ΔU = Q - L
risulta modificato in:
ΔU = - L
in quanto il sistema non scambia calore con l'ambiente esterno. Questo vuol dire che una compressione adiabatica (L<0) comporterà un aumento dell'energia interna (ΔU >0).
E poiché l'energia interna è una funzione di stato della temperatura, cioè dipende solo da essa come variabile, l'effetto sarà quello di un aumento della temperatura finale del gas.
Viceversa un'espansione adiabatica (L>0) comporterà una diminuzione dell'energia interna (ΔU<0) con conseguente raffreddamento del gas.
Il lavoro termodinamico per una trasformazione adiabatica è pari a:
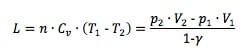
in cui Cv è il calore specifico a volume costante ed n il numero di moli del gas. Dunque possiamo anche scrivere che:
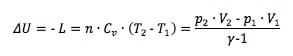
Esercizio
Un cilindro del volume di 3,0 L contiene un gas perfetto monoatomico alla pressione di 1,2∙105 Pa.
Successivamente a una trasformazione adiabatica la pressione diminuisce del 30% rispetto al valore iniziale mentre la temperatura risulta 310 K.
Calcolare il volume finale del gas e il numero di moli contenute nel cilindro.
Stabilire infine se il gas si è raffreddato o riscaldato rispetto alla temperatura iniziale.
Lo svolgimento dell'esercizio lo trovi qui: trasformazione adiabatica su gas perfetto monoatomico.
Studia con noi