Legge di van der Waals
Legge di van der Waals dei gas reali (equazione di stato per i gas reali)
La legge di van der Waals è un'estensione dell'equazione di stato dei gas perfetti con la quale si descrive il comportamento dei gas reali, gas, il cui comportamento, si discosta da quello tipico dei gas ideali.
L'equazione di stato dei gas ideali
![]()
in cui: P = pressione ; V = volume ; n = quantità di sostanza ; T = temperatura, è valida solo per gas che hanno un comportamento che si avvicina a quello di un gas ideale.
Principali differenze tra gas ideale e gas reale da tenere conto nella legge di van der Waals
J. D. van der Waals modificò in modo opportuno l'equazione di stato dei gas ideali in relazione alle due differenze essenziali fra gas reali e gas ideale:
1) nei gas reali il volume materialmente occupato dalle particelle non è trascurabile rispetto al volume del recipiente in cui è contenuto il gas;
2) nei gas reali fra le particelle gassose esistono interazioni (forze attrattive o repulsive) non trascurabili.
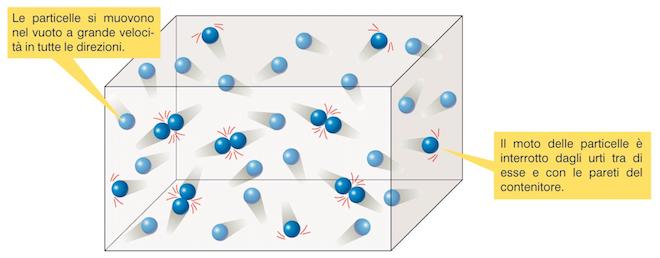
Moto caotico delle particelle di un gas: le particelle di un gas si muovono nel vuoto a grande velocità e in tutte le direzioni; il moto delle particelle è interrotto dagli urti tra di esse e con le pareti del recipiente.
Vediamo nel dettaglio come è stata modificata l'equazione generale dei gas ideali tenendo conto di queste due differenze.
1) Modifica della equazione di stato del gas ideale per la non trascurabilità del volume proprio delle molecole
Se n moli di gas vengono poste in un recipiente di volume V, il volume in cui le particelle possono liberamente muoversi non è ovviamente V ma è la differenza fra V e la parte di V materialmente occupata dall'insieme delle particelle che costituiscono le n moli; se questa parte è trascurabile rispetto a V (gas a bassa pressione) di essa può non tenersi conto; in caso contrario (gas a pressioni elevate) va considerata.
Se indichiamo con b il volume materialmente occupato da una mole di gas (covolume), il volume realmente disponibile per il movimento delle particelle presenti nelle n moli di gas reale è V-n·b, ed è questo volume corretto che deve essere considerato in una equazione di stato valida per i gas reali.
Una conseguenza della diminuzione del volume realmente a disposizione del gas reale è che la pressione di questo risulta maggiore di quella che avrebbe esercitato (nelle stesse condizioni sperimentali) il gas ideale.
2) Modifica della equazione di stato del gas ideale per le interazioni fra le molecole
Se due particelle gassose vengono progressivamente avvicinate, insorgono dapprima forze attrattive, poi, al diminuire della distanza, diventano sensibili le forze repulsive che, successivamente, equilibrano e superano le forze attrattive.
Aggiungiamo che la diminuzione della temperatura, cioè dell'energia cinetica media delle particelle e quindi della loro velocità, accentua gli effetti delle interazioni.
Vediamo ora le correzioni apportate da van der Waals all'equazione di stato del gas ideale per tener conto delle interazioni esistenti fra le molecole di un gas reale.
A pressioni non molto alte (ordine di grandezza 102 atmosfere) tali interazioni sono di tipo attrattivo. Pertanto se in un volume V sono contenute N molecole di gas reale, l'entità delle forze attrattive esistenti nell'unità di volume fra una di esse e tutte le altre è proporzionale al numero di queste ultime, cioè ad N/V; poiché quanto detto per una singola molecola può ripetersi per ciascuna delle N/V molecole contenute nell'unità di volume, l'entità totale delle forze attrattive fra tutte le molecole in essa contenute è proporzionale ad (N/V)·(N/V)=N2/V2.
Se fra le molecole di un gas reale esistono forze attrattive, la durata media di un urto molecolare aumenta con l'aumentare di tali forze e di conseguenza diminuisce il numero di urti nell'unità di tempo; ciò significa che la pressione esercitata dal gas reale (P) è, per questo aspetto, minore di quella (Pid) che esso avrebbe esercitato nelle stesse condizioni sperimentali se fosse stato ideale (assenza di interazioni e quindi urti elastici, istantanei).
Indicando con n il numero di moli corrispondente alle N molecole di gas reale contenute nel volume V e considerando che il valore della differenza Pid-P è proporzionale all'entità delle forze attrattive, cioè a n2/V2, potremo scrivere (indicando con a una costante di proporzionalità):
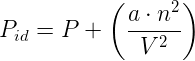
Considerando poi che il volume (Vid) che compare nell'equazione di stato del gas ideale rappresenta il volume realmente a disposizione delle molecole del gas, e che per i gas reali tale volume è dato dal volume geometrico a disposizione del gas (V) diminuito del volume proprio delle particelle, scriveremo, per n moli di gas reale:
![]()
Pertanto, in base a queste due ultime considerazioni, l'equazione di stato del gas ideale:
![]()
risulta così modificata nel caso di un gas reale:
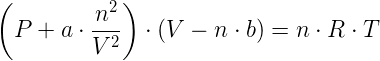
ove P e V rappresentano pressione e volume del gas reale considerato. Tale equazione è l'equazione di stato per i gas reali, nota come equazione di van der Waals.
Per una mole di gas, quest'ultima equazione può anche scriversi come:
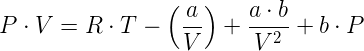
la quale mostra che l'equazione di van der Waals aggiunge al prodotto R·T dell'equazione del gas ideale (P · V = R · T) tre termini correttivi, uno negativo e due positivi; l'entità della correzione dovuta a questi termini diventa trascurabile andando verso le basse pressioni (basso valore di P, alto valore di V) e acquista invece valore sempre maggiore andando verso le alte pressioni.
Valori di a e di b da inserire nell'equazione di stato per i gas reali (equazione di van der Waals)
Di seguito riportiamo i valori di a e di b da inserire nell'equazione di stato per i gas reali (equazione di van der Waals); si tenga presente che a è dato in atm·L2·mol-2 e che b è dato in L·mol-1.
He: a = 0,034 ; b = 0,024
H2: a= 0,25 ; b = 0,027
Ar: a = 1,35 ; b = 0,032
N2: a = 1,40 ; b = 0,039
O2: a = 1,39 ; b = 0,032
CH4: a = 2,25 ; b = 0,043
CO2: a = 3,60 ; b = 0,043
NH3: a = 4,0 ; b = 0,036
C2H4: a = 4,4 ; b = 0,056
H2S: a = 4,4 ; b = 0,043
Cl2: a = 5,5 ; b = 0,049
Link correlati:
Esercizi svolti e commentati sui gas
Esercizio svolto e commentato sul calcolo della densità di un gas
Esercizio sul calcolo del covolume di un gas
Che cos'è il gas di città?
Studia con noi