Actina G e F, contrazione muscolare e integrine
Actina G, actina F, regolazione della contrazione muscolare e integrine
L'actina è la proteina che costituisce i filamenti sottili del sarcomero (unità funzionale delle miofibrille muscolari) e che, insieme alla miosina, attiva la contrazione muscolare.
Questa proteina, inoltre, è presente anche nel citoscheletro e in altre strutture cellulari con funzione di sostegno.
Un filamento di actina assomiglia a due fili di perle avvolti a spirale a formare una doppia elica.
Ogni "perla" è composta da una molecola di actina G (forma globulare del diametro di circa 5,5 nm).
La polimerizzazione di più molecole di actina G porta alla formazione della forma filamentosa, chiamata actina F.
L'attivazione dei monomeri dell'actina G è strettamente correlata al legame con l'ATP e l'assemblaggio è regolato da diverse proteine (per es. timosina, profilina).
La doppia elica dell'actina F ha un giro di circa 73 nm, pertanto i due filamenti si incrociano ogni 36,5 nm.
Tra le due eliche di actina si dispongono le molecole filamentose della tropomiosina.
Lungo il filamento di actina ogni 40 nm è presente un complesso proteico di tre subunità legato alla tropomiosina chiamato troponina.
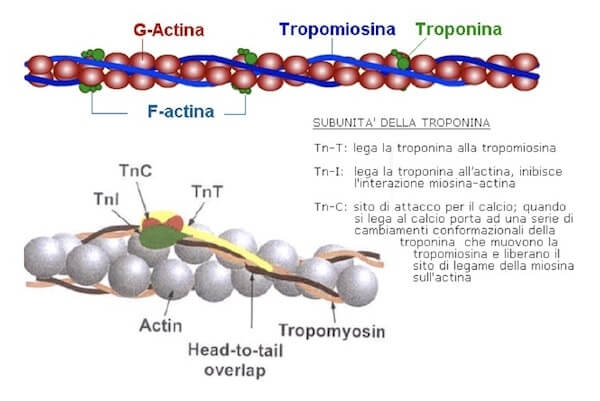
Figura 2. Struttura dell'actina, tropomiosina e subunità della troponina.
I singoli filamenti di actina isolati possono essere evidenziati mediante microscopia elettronica ad elevata risoluzione o mediante studi di diffrazione ai raggi X.
Regolazione contrazione muscolare
Nella muscolatura scheletrica la contrazione viene regolata, oltre che dagli ioni calcio, da tropomiosina e troponina.
La prima molecola è costituita da lunghe e sottili funi doppie, poste lungo le molecole di actina del filamento sottile, che bloccano i siti di legame dei ponti trasversali presenti su quelle molecole.
Mentre le molecole di troponina sono aggregati di proteine globulari situati ad intervalli regolari sulle catene di tropomiosina.
Quando lo ione calcio Ca2+ si combina con le molecole di troponina, queste subiscono un cambiamento conformazionale con conseguente scivolamento delle catene di tropomiosina e l'esposizione dei siti di legame dei ponti trasversali.
L'inizio della contrazione e la disponibilità di calcio dipendono dalla stimolazione del muscolo da parte di un segnale proveniente da un neurone motorio.
Proteine associate all'actina: Integrine
Sono le principali molecole di collegamento delle cellule e di risposta a segnali con la Matrice ExtraCellulare (MEC).
Sono costituite da due subunità glicoproteiche transmembrana (α e β) di dimensioni 120‐170 kDa e 90‐100 kDa, rispettivamente, associate in modo non‐covalente, entrambe contribuiscono al legame con la MEC o con le altre cellule.
Alcune integrine sembrano legarsi soltanto ad un singolo tipo di macromolecola della matrice (ad es. fibronectina o laminina).
Altre invece si legano a più di un tipo: ad es. collagene + fibronectina + laminina.
Alcune integrine riconoscono la tripleta di aminoacidi RGD (arginina ‐ glicina ‐acido aspartico).
Altre riconoscono altre sequenze aminoacidiche o domini proteici.
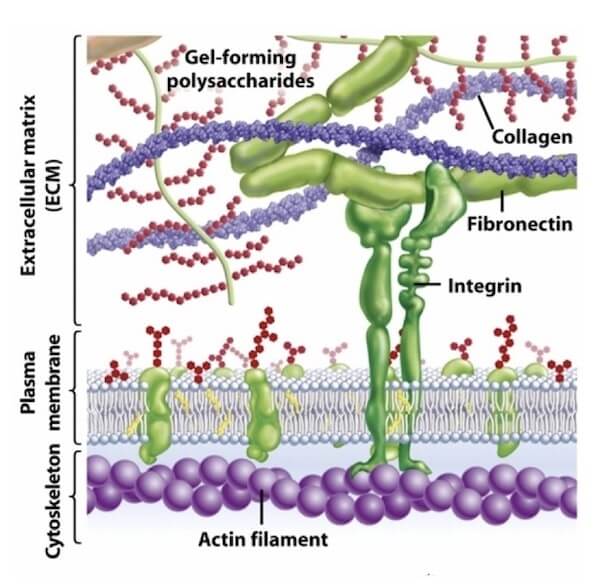
Figura 3. Integrina e filamenti di actina
La stessa molecola di integrina in diversi tipi cellulari può avere diverse cinetiche di legame con il ligando.
Attualmente sono noti almeno 24 tipi diversi di integrine, dati dalla combinazione di 8 tipi diversi di subunità β e 18 tipi diversi di subunità α.
La diversità delle integrine è aumentata dalla possibilità di diversi tipi di "splicing" sullo stesso RNA messaggero.
La combinazione delle subunità α e β determina la specificità di legame e le proprietà delle singole integrine.
Alcune integrine (es. α5β1) riconoscono principalmente un singolo ligando, mentre altre (es. αvβ3) possono legarsi a diversi ligandi.
La α5β1 lascia le adesioni focali (FA) e si muove lungo il filamento di actina F per formare adesioni fibrillari.
Questo porta allo stiramento della molecola di FN legata, creando una tensione meccanica tramite il citoscheletro di actina e provocando la comparsa in superficie di siti di auto-assemblaggio.
Studia con noi