Esercizio sull'equazione di Clausius–Clapeyron
Esercizio svolto sull'equazione di Clausius–Clapeyron
Sapendo che alla pressione di 1 atm l'acqua bolle alla temperatura di 100°C, si determini a quale temperatura bolle l'acqua alla pressione di 0,48 atm. Si consideri ΔHeb = 539 kcal/kg.
Svolgimento dell'esercizio
L'esercizio propone il calcolo della temperatura di ebollizione dell'acqua mantenuta alla pressione di 0,48 atm. L'equazione che mette in relazione la temperatura di ebollizione di una sostanza con la pressione alla quale viene mantenuta, è l'equazione di Clapeyron nota anche come equazione di Clausius–Clapeyron:
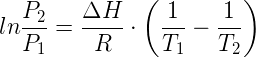
in cui:
- T1 è la temperatura assoluta di ebollizione dell'acqua alla pressione P1;
- T2 è la temperatura assoluta di ebollizione dell'acqua alla pressione P2;
- ΔH è l'entalpia di ebollizione;
- R = 8,314 (Pa·m3)/(mol·K) = 8,314 J/(mol·K)
Trasformiamo la temperatura t1 in kelvin:
T1 = 100 + 273 = 373 K
Alla temperatura T1 = 373 K è associata la pressione P1 = 1 atm.
La temperatura T2 è invece la nostra incognita; P2 è invece pari a 0,48 atm.
Convertiamo il ΔH da kcal/kg a J/mol. Per effettuare questa conversione bisogna prima trasformare le kcal in J e poi i kg in mol.
Ricordando che 1 kcal = 4184 J, si ha che:
ΔH= 539 kcal/kg = 2.255.176 J/kg
Ricordando che in 1 kg di acqua sono presenti 55,5 mol si ha che:
2.255.176 J/kg = 40.634 J/mol
Sostituendo i dati a nostra disposizione nella formula precedente, si ha che:
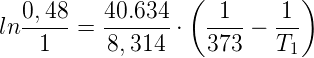
Da cui:
-0,734 = 4887,42 · [(1/373) - (1/T1)]
- 1,502 · 10-4 = (1/373) - (1/T1)
- 1,502 · 10-4 - 1/373 = - (1/T1)
- 2,831 · 10-3 = - (1/T1)
2,531 · 10-3 = 1/T1
T1 = 353 K
Trasformiamo la temperatura T1 in gradi centigradi:
t1 = 353 - 273 = 80°C
Pertanto alla pressione di 0,48 atm l'acqua bolle alla temperatura di 80°C.
Link correlati:
Esercizio sulla regola di Trouton
Studia con noi