Esercizi sulle miscele isotopiche
Esercizi sulle miscele isotopiche e sul calcolo della massa atomica di un elemento conoscendo la abbondanza relativa degli isotopi
La maggior parte degli elementi che si trovano in natura sono costituiti da una miscela di isotopi che presenta una composizione costante.
Ciascun isotopo presente nella miscela ha invece una massa atomica diversa da quella degli altri isotopi.
Per ogni elemento chimico il valore della massa atomica riportato nella tavola periodica non si riferisce alla massa atomica di un singolo isotopo ma rappresenta la media ponderata delle masse atomiche di tutti gli isotopi.
La media ponderata tiene conto della abbondanza in natura di ciascun isotopo.
La media ponderata delle masse atomiche di ciascun isotopo presente nella miscela viene calcolata dividendo per 100 la somma dei prodotti delle masse atomiche di ciascun isotopo per le relative abbondanze naturali.
In altre parole, indicando con 1, 2 ,3 ,ecc. gli isotopi dell'elemento, la media ponderata viene calcolata nel seguente modo:
![]()
In cui:
MA = indica la massa atomica dei vari isotopi;
% indica l'abbondanza percentuale dei vari isotopi.
Di seguito vengono proposti alcuni esercizi riguardanti le miscele isotopiche. Gli esercizi sono svolti e commentati.
Chimica-online.it inoltre ti offre anche una calcolatrice scientifica.
Livello di difficoltà: medio-basso
1.
Determina la massa atomica del cloro sapendo che il cloro naturale è costituito da due isotopi con le seguenti caratteristiche:
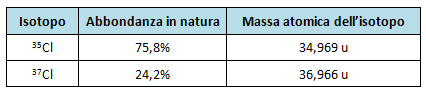
La soluzione dell'esercizio la trovi qui: massa atomica ed abbondanza isotopica.
2.
Determina la massa atomica del potassio sapendo che il potassio naturale è costituito dai seguenti tre isotopi:
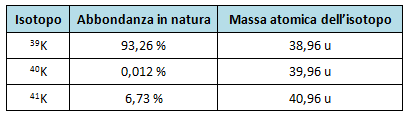
La soluzione dell'esercizio la trovi qui: esercizio sulla massa atomica del potassio.
Livello di difficolta:medio-alto
1.
Il bromo naturale, (MA = 79,904 u) è formato da due isotopi le cui masse sono rispettivamente 78,92 u e 80,92 u. Qual è l'abbondanza % dei due isotopi?
La soluzione dell'esercizio la trovi qui: abbondanza percentuale dei due isotopi del bromo.
2.
Il carbonio naturale (MA = 12,011 u) è costituito da due isotopi. Uno dei due isotopi ha una abbondanza percentuale del 98,90 % e una massa di 12,00 u. Determinare la massa del secondo isotopo.
La soluzione dell'esercizio la trovi qui: massa di uno dei due isotopi del carbonio.
Studia con noi