Struttura del benzene
Aromaticità e la struttura del benzene
Il benzene è un idrocarburo avente formula chimica C6H6, è il capostipite dei composti aromatici e la sua struttura è simile a quella di un cicloesatriene:
Sperimentalmente è stato possibile dimostrare che il benzene ha però alcune caratteristiche inaspettate:
- tutti i legami carbonio - carbonio sono equivalenti ed hanno una lunghezza che è superiore a quella di un doppio legame ma inferiore a quella di un singolo legame.
- il calore di idrogenazione del benzene (49,8 kcal/mol) è inferiore a quello del cicloesatriene di ben 36 kcal/mol, il che fa pensare a una maggior stabilità del benzene rispetto a quella del cicloesatriene.
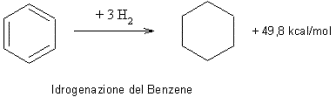
Questa differenza di energia viene detta energia di coniugazione o anche energia di risonanza.
Questi fatti sperimentali fanno supporre che nel benzene possa esserci risonanza.
La risonanza è quel fenomeno secondo cui una molecola può essere rappresentata solo attraverso diverse strutture che differiscano tra loro per una diversa distribuzione degli elettroni.
Di queste strutture chiamate strutture limite di risonanza, nessuna rappresenta la vera struttura della molecola che è piuttosto un ibrido fra le varie forme limite. Le strutture limite di risonanza sono rappresentate da una freccia con due punte <—>
Per il benzene si hanno le due seguenti forme limite:
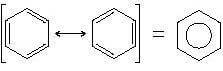
La risonanza è in grado di spiegare entrambi i dati sperimentali descritti in precedenza. Infatti:
- ogni legame C-C è un ibrido tra un singolo e un doppio legame, pertanto la sua lunghezza sarà intermedia tra quella di un singolo e quella di un doppio legame.
- la risonanza implica stabilità. Nel benzene pertanto la risonanza contribuisce alla stabilità della molecola. Questo spiega il minor contenuto energetico del benzene rispetto al cicloesatriene e quindi la maggior stabilità e il minor valore del calore di idrogenazione.
Ogni atomo di carbonio del benzene è ibridato sp2 con geometria trigonale planare e angoli di 120°:
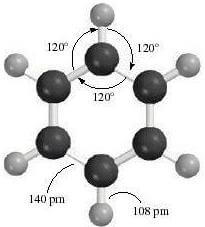
I restanti sei orbitali di tipo p, uno su ciascun atomo di carbonio, sono disposti perpendicolarmente al piano della molecola, sono paralleli fra loro e si sovrappongono lateralmente. Tale sovrapposizione non avviene però per coppie di orbitali (si formerebbero in questo caso tre doppi legami) ma interessa contemporaneamente tutti e sei gli orbitali p con formazione di un unico orbitale a forma di anello:
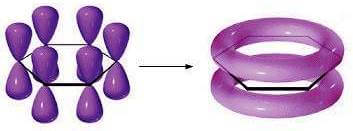
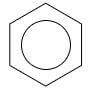
È per questo motivo che spesso la struttura del benzene viene rappresentata da un esagono con un cerchio al suo interno:
Teoria degli orbiali molecolari applicata al benzene
In realtà, la rappresentazione dell'orbitale benzenico come di un unico orbitale a forma di anello è utile, ma inesatta. La teoria degli orbitali molecolari (teoria MO) dà una rappresentazione più corretta della formazione del sistema p anulare del benzene.
I sei orbitali atomici 2p, paralleli tra loro e perpendicolari al piano dell'anello, si combinano tra loro per formare altrettanti orbitali molecolari p di cui tre sono orbitali molecolari di legame (p1, p2, p3) e i tre sono orbitali molecolari di antilegame (p4*, p5*, p6*). I sei elettroni del sistema p sono collocati nei tre orbitali molecolari di legame (p1, p2, p3).
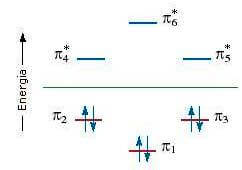
La particolare stabilità del benzene è dovuta proprio al fatto che tutti gli orbitali molecolari di legame sono pieni, mentre tutti gli orbitali molecolari diantilegame (p4*, p5*, p6*) sono vuoti. Tale configurazione è detta a guscio chiuso.
Esercizi sui composti aromatici
Li trovi al seguente link: esercizi sul benzene.
Link correlati:
Per quale motivo il benzene non dà reazioni di addizione?
Studia con noi