Stabilità dei radicali al carbonio
Qual è l'ordine di stabilità dei radicali al carbonio e dei radicali alchilici?
I radicali sono entità atomiche o molecolari, che presentano un elettrone spaiato (ovvero un elettrone solitario non accoppiato). La peculiarità di tale elettrone è di rendere il radicale estremamente reattivo e in grado di legarsi ad altri radicali o di sottrarre un elettrone ad altre molecole.
In questa lezione vedremo qual è l'ordine di stabilità dei radicali al carbonio, ovvero di quei radicali che coinvolgono l'atomo di carbonio.
Qual è l'ordine di stabilità dei radicali al carbonio?
Nell'immagine seguente viene riportato l'ordine di stabilità di vari radicali al carbonio. In questa scala abbiamo considerato: il radicale trifenilmetilico, il radicale benzilico, il radicale allilico, i radicali alchilici (terziario, secondario primario, metilico), il radicale vinilico e il radicale fenilico.
La stabilità di questi radicali al carbonio è di seguito riportata:
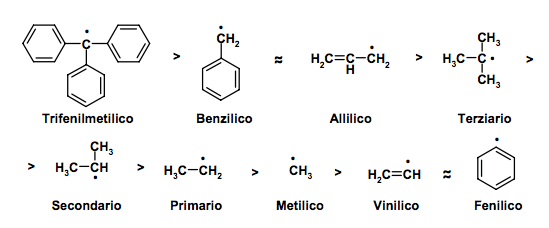
Cerchiamo ora di giustificare l'ordine di stabilità. Il radicale trifenilmetilico è il più stabile in assoluto; la sua stabilità è dovuta alla risonanza dell'elettrone spaiato sugli anelli aromatici (sono possibili dieci forme di risonanza, nelle quali l'elettrone spaiato è delocalizzato su ciascun anello aromatico sia nelle due posizione orto che nella posizione para).
Per il radicale benzilico è possibile scrivere "solo" quattro forme di risonanza (in tre delle quali l'elettrone spaiato è delocalizzato sull'anello aromatico nelle due posizioni orto e nella posizione para). Avendo meno forme di risonanza del radicale trifenilmetilico il radicale benzilico è meno stabile.
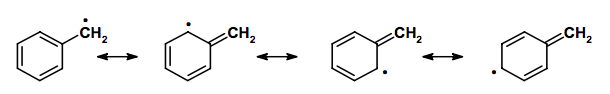
Il radicale allilico, per il quale è possibile scrivere due forme di risonanza, è meno stabile del radicale benzilico.
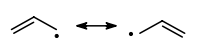
Ordine di stabilità dei radicali alchilici
Rispetto ai radicali visti in precedenza, i radicali alchilici (terziario, secondario primario, metilico) sono meno stabili in quanto non possiedono forme di risonanza.
Il loro ordine di stabilità (radicale terziario > radicale secondario > radicale primario > radicale metilico) è dovuto al fenomeno dell'iperconiugazione. Tale fenomeno consiste nella delocalizzazione degli elettroni attraverso legami σ anziché π.
Come mostrato nella figura seguente, le forme iperconiugative che si ottengono portano al trasferimento dell'elettrone su atomi di idrogeno.
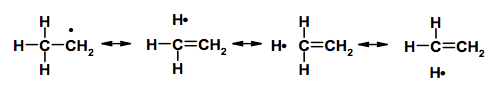
N.B. : come è possibile notare, la stabilità dei radicali alchilici segue l'ordine di stabilità dei carbocationi.
Chiudono infine l'ordine di stabilità dei radicali al carbonio il radicale vinilico e il radicale fenilico, privi di ogni forma di stabilità.
Studia con noi