Influenza della presenza di un catalizzatore sulla velocità di reazione
Relazione di laboratorio
Introduzione
Il permanganato di potassio (KMnO4) è una sostanza violetta che colora intensamente la sua soluzione.
Reagendo con l'acido ossalico (H2C2O4) in ambiente acido per aggiunta di H2SO4, il permanganato di potassio porta alla formazione dello ione Mn2+ di colore rosa chiaro ma che appare incolore in soluzione diluita.
La totale decolorazione della soluzione indica quindi la scomparsa del permanganato e il completamento della reazione.
![]()
I catalizzatori sono sostanze che aggiunte in piccole quantità ad una reazione chimica, modificano il valore della velocità di reazione senza venire consumati durante la reazione stessa.
La reazione in ambiente acido tra permanganato di potassio e acido ossalico è catalizzata dalla presenza in soluzione di ioni Mn2+, pertanto, in presenza di questo catalizzatore, la decolorazione della soluzione avviene in tempi più rapidi.
Scopo della esperienza
Verificare l'influenza della presenza di un catalizzatore (ioni Mn2+) sulla velocità della reazione in ambiente acido tra permanganato di potassio e acido ossalico.
Attrezzature
2 becher da 200 mL
2 cilindri graduati da 50 mL
Bacchetta di vetro
Cronometro
Materiali e reagenti
Soluzione di KMnO4 0,02 M
Soluzione di H2C2O4 0,1 M
H2SO4 conc.
Solfato di manganese (MnSO4) in cristalli
Procedimento
Versare in ciascuno dei due becher 50 mL della soluzione di acido ossalico e 5 mL della soluzione di acido solforico concentrato.
In uno solo dei due becher aggiungere alcuni cristalli di solfato di manganese e scioglierli agitando con la bacchetta di vetro.
Versare in due cilindri graduati due aliquote da 50 mL della soluzione di permanganato di potassio.
Versare contemporaneamente le due aliquote di permanganato di potassio nei due becher contenenti la soluzione di acido ossalico.
Azionare il cronometro.
Annotare i tempi impiegati dalle due reazioni per raggiungere la totale decolorazione della soluzione (completamento della reazione).
Elaborazione ed analisi dei dati
Completare la seguente tabella
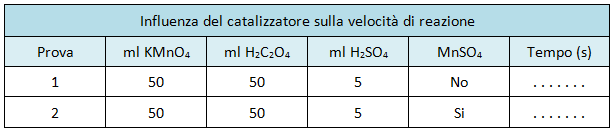
Conclusioni
Si dovrebbe ossrvare che, in presenza di catalizzatore (prova 2), la decolorazione della soluzione avviene in tempi più rapidi.
Studia con noi