Calcolo della concentrazione dello ione dietilammonio
Esercizio sul calcolo della concentrazione dello ione dietilammonio
Triplicando con acqua il volume di una soluzione 3,0∙10-2 M di dietilammina (Kb = 2,1∙10-5), si determini di quanto si riduce, in termini percentuali, la concentrazione dello ione dietilammonio.
Svolgimento dell'esercizio
L'esercizio propone il calcolo della riduzione della concentrazione dello ione dietilammonio quando si triplica con acqua il volume di una soluzione 3,0∙10-2 M di dietilammina.
La dietilammina è una ammina secondaria con formula generica R2NH che in acqua si comporta da base formando lo ione dietilammonio (R2NH2+):
R2NH + H2O ⇆ R2NH2+ + OH−
La [OH−] può essere calcolata con la seguente formula relativa al calcolo del pH di una base debole:
![]()
Ma siccome [OH−] = [R2NH2+] risulta anche che: [R2NH2+] = 7,94 ∙ 10-4 M e quindi la concentrazione dello ione dietilammonio prima della diluizione è 7,94 ∙ 10-4 M.
Calcoliamo ora la concentrazione dello ione dietilammonio quando il volume della soluzione viene triplicato. Se il volume della soluzione viene triplicato la concentrazione della soluzione diventa un terzo, ovvero:
C2 = 3,0 ∙ 10-2 M / 3 = 1,0 ∙ 10-2 M
Con la stessa formula vista in precedenza calcoliamo ora la [OH−] relativa alla concentrazione finale dopo la diluizione:
![]()
Ma siccome [OH−] = [R2NH2+] risulta anche che: [R2NH2+] = 4,58 ∙ 10-4 M e quindi la concentrazione dello ione dietilammonio è 4,58 ∙ 10-4 M.
Pertanto la concentrazione dello ione dietilammonio passa da un valore iniziale di 7,94 ∙ 10-4 M a un valore finale di 4,58 ∙ 10-4 M.
Calcoliamo infine di quanto si riduce la concentrazione dello ione dietilammonio:
ΔC = 7,94 ∙ 10-4 - 4,58 ∙ 10-4 = 3,36 ∙ 10-4 M
Che in termini percentuali significa:
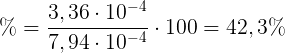
Pertanto, in termini percentuali, triplicando con acqua il volume della soluzione la concentrazione dello ione dietilammonio si riduce del 42,3%.
Studia con noi