Tampone con l'acido fosforico
Esercizio su un tampone ottenuto con l'acido fosforico
Determinare i grammi di NaOH che bisogna aggiungere a 1,2 dm3 di una soluzione di H3PO4 0,15 M per preparare un tampone a pH = 11,8.
Ka3 (H3PO4) = 1,0 · 10-12
Svolgimento dell'esercizio
Determiniamo le moli di acido fosforico H3PO4 presenti nella soluzione iniziale moltiplicando la molarità per il volume in litri (1,2 dm3 = 1,2 l):
n (H3PO4) = M · V = 0,15 mol/l · 1,2 l = 0,18 mol
Occorrono 0,18 · 2 = 0,36 moli di NaOH per trasformare quantitativamente H3PO4 in HPO42− secondo la reazione:
H3PO4 + 2 OH− → HPO42− + 2 H2O
Occorre ancora NaOH per trasformare la quantità desiderata di HPO42− in PO43− secondo la reazione:
HPO42− + OH− → PO43− + H2O
Determiniamo la [H+] sapendo che il pH = 11,8.
Per eseguire questo calcolo bisogna applicare la formula inversa per il calcolo del pH, ovvero:
![]()
Sostituendo il nostro valore, si ha:
[H+] = 10-pH = 10-11,8 = 1,58 · 10-12
Ora, applichiamo la formula per il calcolo di tamponi acidi:
![]()
Da cui:
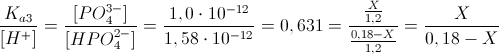
da cui:
X = 7,0 · 10-2
Quindi le moli totali di NaOH necessarie sono: 0,36 + 0,07 = 0,42 mol
Moltiplicando infine le moli di NaOH per il valore della sua massa molare, è possibile determinare la massa in grammi di NaOH:
g (NaOH) = n · Mm= 0,42 mol · 40 g/mol = 16,8 g
Quindi i grammi di NaOH da aggiungere sono 16,8 g.
Studia con noi