Esercizio sulla legge di Raoult
Esercizio svolto sulla legge di Raoult
Una soluzione costituita da metanolo (MM = 32,03 g/mol) ed etanolo (MM = 46,05 g/mol) presenta, alla temperatura di 298 K, una pressione di vapore di 69,95 mmHg.
Sapendo che alla stessa temperatura la pressione di vapore del metanolo vale 88,0 mmHg e quella dell'etanolo vale 44,0 mmHg, si determini la composizione percentuale in massa della soluzione.
Svolgimento dell'esercizio
Indichiamo come componente a) il metanolo e come componente b) l'etanolo.
L'esercizio si basa sulle legge di Raoult, secondo cui la tensione di vapore della soluzione è data dalla somma delle tensioni di vapore dei due componenti che la formano.
Pertanto:
P = P°a · Xa + P°b · Xb
in cui:
- P°a = pressione di vapore del componente a)
- Xa = frazione molare del componente a)
- P°b = pressione di vapore del componente b)
- Xb = frazione molare del componente b)
Dobbiamo determinare la composizione percentuale della soluzione, per cui consideriamo 100 g di soluzione.
In questi 100 g, X saranno i grammi del componente a) e 100-X i grammi del componente b).
Le moli del componente a) sono:
na = g / MM = X / 32,03
Le moli del componente b) sono:
nb = g / MM = (100-X) / 46,05
Le moli totali sono:
na + nb = X / 32,03 + [(100-X) / 46,05]
La frazione molare del componente a) è:
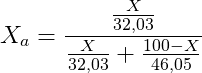
La frazione molare del componente b) è invece:
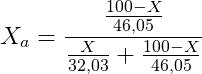
Ricordando che:
P = P°a · Xa + P°b · Xb
Si ha che:
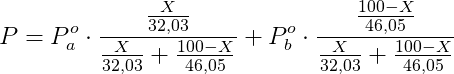
Sostituendo i dati in nostro possesso, si ha che:
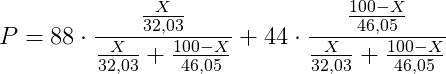
Si tratta di una equazione ad una incognita.
Risolvendo si ha che:
X = 50 g
Pertanto:
%m/m (metanolo) = 50 %
%m/m (etanolo) = 50 %
Studia con noi